在100 mL混合液中,HNO3和H2SO4的物质的量浓度分别是0.4 mol·L-1和0.1 mol·L-1,向该混合液中加入1.92 g铜粉,加热充分反应后,所得溶液中Cu2+的物质的量浓度是( )
| A.0.15 mol·L-1 | B.0.225 mol·L-1 |
| C.0.35 mol·L-1 | D.0.45 mol·L-1 |
A~H等8种物质存在如下转化关系(反应条件、部分产物未标出)。已知A是正盐,B是能使品红溶液褪色的气体,G是红棕色气体。按要求回答问题: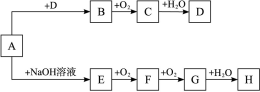
(1)写出下列物质的化学式:A______,B______,C______。
(2)写出下列反应的化学方程式:
E―→F________________________________________________________________________;
G―→H________________________________________________________________________;
D的浓溶液与木炭反应的方程式:________________________。
(3)检验某溶液中是否含D中阴离子的方法是______________________。
某合金(仅含铜、铁)中铜和铁的物质的量之和为y mol,其中Cu的物质的量分数为a,将其全部投入50 mL b mol·L-1的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。下列说法正确的是( )
| A.若金属有剩余,在溶液中再滴入硫酸后,金属又开始溶解 |
| B.若金属全部溶解,则溶液中一定含有Fe3+ |
| C.若金属全部溶解,且产生336 mL气体(标准状况),则b=0.3 |
| D.当溶液中金属离子只有Fe3+、Cu2+时,则a与b的关系为:b≥80y(1-) |
实验室里化学试剂的保存方法是不相同的,下图中A、B、C、D是常见的一些保存药品的试剂瓶。请把下列常见试剂的序号填写在各试剂瓶下面的括号内:①浓硫酸②碳酸钠溶液③大理石④酒精⑤氯水⑥浓硝酸
| A |
B |
C |
D |
 |
 |
 |
 |
| ( ) |
( ) |
( ) |
( ) |
下列溶液中加入氯化钡溶液生成白色沉淀,在加入稀硝酸震荡,白色沉淀不消失的是
| A.Na2SiO3 | B.Na2CO3 | C.Na2SO3 | D.Na3PO4 |
在一定条件下可实现下图所示物质之间的变化
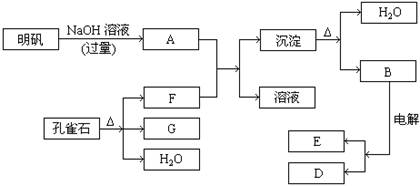
请填写以下空白:
(1)孔雀石的主要成份是CuCO3·Cu(OH)2(碱式碳酸铜)受热易分解。上图中的F是 。
(2)写出明矾溶液与过量的NaOH溶液反应的离子方程式
(3)图中所得G和D都为固体混合后在高温下可发生反应写出该反应化学方程式 。
(4)每生成1mol D同时生成 mol E。
某地有一池塘,生长着丰富的水生植物和多种鱼虾。后来,由于化工厂将大量污水排入池塘中,使水质恶化,各种水生生物先后死亡。根据题意回答下列问题:
(1)从生态平衡角度看,池塘这种变化说明了 。
(2)造成这种变化的原因是 。
(3)经检测,污水中含有0.012 mol·L-1的游离溴。可用亚硫酸钠除去污水中的溴,请写出其化学方程式 。
(4)处理这种污水5 L,需加入0.05 mol·L-1的亚硫酸钠__________L,才能将溴全部除去。
(5)要使池塘恢复本来面目.首先要解决的问题是__________.首先要恢复的生物是__________。
把7.4gNa2CO3·10H2O和NaHCO3组成的混合物溶于水,配成100mLD 溶液,其中c(Na+)=0.6mol/L.若把等质量的混合物加热到恒重时,残留物的质量是( )
| A.3.18g | B.2.21g | C.5.28g | D.4.22g |
根据下图所示的A、B、C、D、E 五种物质的相互转化关系,按如下关系填写相应的物质和有关反应的化学方程式: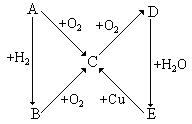
(1)当A是气体单质时,B是_________,C是____________,E是______________,由D 生成E的反应的化学方程式是__________________。
(2)当A是固体单质时,A是_________,B是____________,D是______________,由E 生成C的反应的化学方程式是__________________。
大气压强对许多物理实验和化学实验有着重要影响,制取氨气并完成喷泉实验。
(1)写出实验室制取氨气的化学方程式: 。
(2)收集氨气应使用 法,要得到干燥的氨气可选用 作干燥剂。
(3)用图1装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是 ,该实验的原理是 。
(4)如果只提供如图2的装置,请说明引发喷泉的方法。
水蒸气通过灼热的煤所产生的混合气,其主要成分是CO、H2,还含有CO2和水蒸气,请用下图所示装置设计一个实验,以确认上述混合气中含有CO和H2。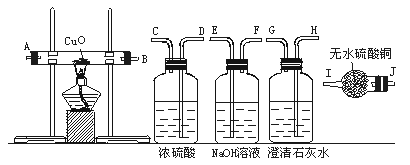
(1)连接上述装置的正确顺序是:(填接口字母)混合气→( ),( )接( ),( )接( ),( )接( ),( )接( ),( ).
(2)确认混合气中含有H2的实验现象是__________,其理由是_________________。
强热条件下,硫酸亚铁固体发生分解:2FeSO4=Fe2O3+SO2↑+SO3↑,如将此反应生成的气体通入BaCl2溶液中,则( )
| A.析出BaSO3沉淀 | B.析出BaSO4沉淀 |
| C.逸出SO3气体 | D.逸出SO2气体 |
将4.68gNaNO3、NaCl、Na2CO3的混合物溶于水,向其中滴加30mL1.00mol/LAgNO3溶液后,不再有沉淀生成。过滤后,使沉淀与足量稀硝酸作用,产生112mL(标准状况)气体。计算原混合物中NaCl的质量分数。
试题篮
()