[化学--选修3:物质结构与性质]
研究发现,在 低压合成甲醇反应 中, 氧化物负载的 氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(1) 基态原子核外电子排布式为________。元素 与O中,第一电离能较大的是________,基态原子核外未成对电子数较多的是________。
(2) 和 分子中 原子的杂化形式分别为________和________。
(3)在 低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为________,原因是________。
(4)硝酸锰是制备上述反应催化剂的原料, 中的化学键除了 键外,还存在________。
(5) 具有 型结构(如图),其中阴离子采用面心立方最密堆积方式, 射线衍射实验测得 的晶胞参数为 ,则 为________ 。 也属于 型结构,晶胞参数为 ,则 为________ 。

【选修三:物质结构与性质】磷酸亚铁锂(
)可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点,文献报道可采用
、
、
和苯胺等作为原料制备。回答下列问题:
(1)在周期表中,与Li的化学性质最相似的邻族元素是________,该元素基态原子核外M层电子的自旋状态________(填"相同"或"相反")。
(2) 中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的 的结构式为________,其中Fe的配位数为________。
(3)苯胺  )的晶体类型是________。苯胺与甲苯(
)的晶体类型是________。苯胺与甲苯(  )的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是________。
)的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是________。
(4) 中,电负性最高的元素是________;P的________杂化轨道与O的2p轨道形成________键。
(5) 和 属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如下图所示:
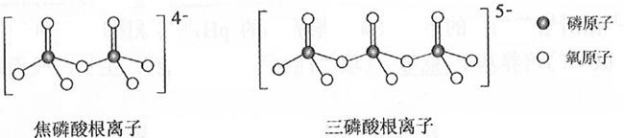
这类磷酸根离子的化学式可用通式表示为________(用 n代表P原子数)。
锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子核外电子排布式为________。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能 ________ (填"大于"或"小于")。原因是________。
(3) 具有较高的熔点(872 ℃),其化学键类型是________; 不溶于有机溶剂而 、 、 能够溶于乙醇、乙醚等有机溶剂,原因是________。
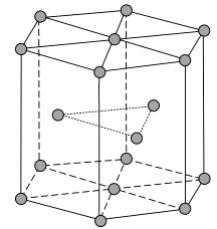
(4)《中华本草》等中医典籍中,记载了炉甘石( )入药,可用于治疗皮肤炎症或表面创伤。 中,阴离子空间构型为________,C原子的杂化形式为________。 (5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为________。六棱柱底边边长为 acm,高为 ccm,阿伏加德罗常数的值为 , Zn的密度为________ (列出计算式)。
过渡金属元素铬 是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:
(1)对于基态 原子,下列叙述正确的是 (填标号)。
A.轨道处于半充满时体系总能量低,核外电子排布应为
B. 电子能量较高,总是在比 电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
(2)三价铬离子能形成多种配位化合物。 中提供电子对形成配位键的原子是 ,中心离子的配位数为 。
(3) 中配体分子 、 以及分子 的空间结构和相应的键角如图所示。
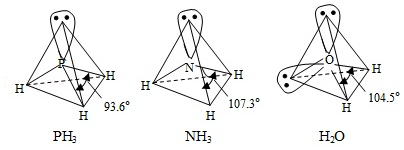
中 的杂化类型是 。 的沸点比 的 ,原因是 。 的键角小于 的,分析原因 。
(4)在金属材料中添加 颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。 具有体心四方结构,如图所示。处于顶角位置的是 原子。设 和 原子半径分别为 和 ,则金属原子空间占有率为 %(列出计算表达式)。

试题篮
()