(12分)聚合硫酸铁铝(PFAS)是一种新型高效水处理剂。利用硫铁矿烧渣(主要成分为Fe3O4、FeO、SiO2等)为铁源、粉煤灰(主要成分为Al2O3、Fe2O3、FeO等)为铝源,制备PFAS的工艺流程如下:
(1)“碱溶”时,Al2O3发生反应的化学方程式为 。
(2)“酸溶Ⅱ”时,Fe3O4发生反应的离子方程式为 。
(3)“滤渣Ⅰ”、“滤渣Ⅱ”在本流程中能加以利用的是 。
(4)“氧化”时应控制温度不超过57℃,其原因是 。
(5)“氧化”时若用酸性高锰酸钾溶液代替,发生反应的离子方程式是 。
(6)酸度对絮凝效果和水质有显著影响。若产品中残留过多,使用时产生的不良后果是
(10分)碳酸铈[Ce2(CO3)3]为白色粉末,难溶于水,主要用作生产铈的中间化合物。它可由氟碳酸铈精矿经如下流程。
(1)氟碳酸铈的化学式为为CeFCO3,该化合物中,Ce的化合价为 。
(2)氧化焙烧生成的铈化合物为二氧化铈(CeO2),其在酸浸时发生反应的离子方程式为 。
(3)试剂X是 。
(4)若试剂X改为氢氧化钠溶液,则反应生成难溶物—一氢氧化铈(Ⅲ),其暴露于空气中时变成紫色,最终变成黄色的氢氧化高铈(Ⅳ)。氢氧化铈在空气中被氧化成氢氧化高铈的化学方程式为 。
(5)取(4)中得到的Ce(OH)4产品(质量分数为97%)1. 00 g,加硫酸溶解后,用0.1000mol·L-1的FeSO4溶液滴定至终点(铈被还原成Ce3+),则需要滴加标准溶液的体积为 mL。
钡盐行业生产中排出大量的钡泥,主要含有BaCO3、BaSiO3、BaSO3、Ba(FeO2)2等。某主要生产BaCl2、BaCO3、BaSO4的化工厂利用钡泥制取Ba(NO3)2,其部分工艺流程如下(已知溶液中Fe3+沉淀完全的pH=3.7):
(1)酸溶后溶液中pH=1,Ba(FeO2)2与HNO3的反应化学方程式为 。
(2)酸溶时通常控制反应温度不超过70℃,且不使用浓硝酸,原因是 。
(3)该厂结合本厂实际,选用的X为 (填化学式);中和Ⅰ使溶液中 (填离子符号)的浓度减少(中和Ⅰ引起的溶液体积变化可忽略)。
(15分)三氯氧磷(POCl3)无色液体,易水解。用于制取染料中间体,有机合成的氯化剂和催化剂,阻燃剂。还常用作半导体掺杂剂及光导纤维原料。氯化水解法生产三氯氧磷的流程如下:

(1)在反应釜中氯化水解法生产三氯氧磷的化学方程式为 。反应中应控制氯气和水的质量比为3.94,若质量比过小,会导致三氯氧磷产率降低,试分析原因 。
(2)经吸收塔吸收后得到副产品,副产品为 (写名称)。
(3)通过佛尔哈德法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
Ⅰ.取a g产品于锥形瓶中,加入足量NaOH溶液,待完全水解后加稀硝酸至酸性。
Ⅱ.向锥形瓶中加入0.1000 mol·L-1的AgNO3溶液40.00 mL,使Cl-完全沉淀。
Ⅲ.向其中加入2 mL硝基苯,用力摇动,使沉淀表面被有机物覆盖。
Ⅳ.加入指示剂,用c mol·L-1NH4SCN溶液滴定过量Ag+至终点,记下所用体积。
已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12
①滴定选用的指示剂是 (选填字母),滴定终点的现象为 。
a.FeCl2 b.NH4Fe(SO4)2 c.淀粉 d.甲基橙
②实验过程中加入硝基苯的目的是 ,如无此操作所测Cl元素含量将会 (填“偏大”、“偏小”或“不变”)
(4)氯化水解法生产三氯氧磷会产生含磷(主要为H3PO4、H3PO3等)废水,某研究小组想把含磷废水中磷元素转化为磷酸钙沉淀除去,实验操作为 。
可选用的试剂:漂白粉 生石灰 氯化
| |
最佳沉淀pH |
| 磷酸氢钙 |
7.0——7.6 |
| 磷酸钙 |
9.0——11 |
Ba(OH)2是重要的化工原料,工业上采用重晶石(主要成分为硫酸钡)和软锰矿(主要成分为二氧化锰,含有二氧化硅杂质)制备,同时得到碳酸锰等副产品。其工业流程如下:

已知:MnO2为两性氧化物,MnO为碱性氧化物。
(1)高温还原过程中,硫酸钡被碳还原为BaS,然后水浸得到。投料时煤炭的量相对要多其作用除了使硫酸钡充分反应外,还有 。
(2)氧化时反应还生成MnO和一种固体产物,则该反应的化学方程式为 ,氧化时控制MnO2与BaS的投料比在2~3之间,若投料比大于4,则Ba(OH)2的转化率明显降低,原因可能是
(3)酸化的离子反应方程式为 ,滤渣的主要成分为 。
(4)中和时通入氨气调节溶液的pH值,若pH值偏高,会造成碳酸锰不纯,原因是 。
工业上用闪锌矿(主要成分为ZnS,还含有CdS、Fe2O3等杂质)为原料生产ZnSO4·7H2O的工艺流程如下:(已知Cd的金属活动性介于Zn和Fe之间)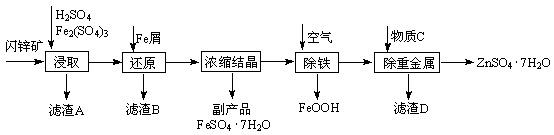
(1)从滤渣A中可获得一种淡黄色非金属单质的副产品,其化学式为 。
(2)浸取时Fe2(SO4)3与ZnS发生反应的化学方程式为 。
(3)除铁过程控制溶液的pH在5.4左右,该反应的离子方程式为 。
该过程在空气入口处设计了一个类似淋浴喷头的装
置,其目的是 。
(4)置换法除去重金属离子Cd2+,所用物质C为 。
(5)取28.70 g ZnSO4·7H2O加热至不同温度,剩余固体的质量变化如图所示。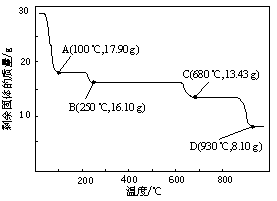
680℃时所得固体的化学式为 。
a.ZnO b.Zn3O(SO4)2 c.ZnSO4 d.ZnSO4·H2O
MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节。某研究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2的实验,其流程如下:
(1)在第①步反应中,为加快反应速率,可采取的措施有 (任写一种),产生CO2气体的的方程式是 ;
(2)写出步骤②中所发生的离子方程式 ;
(3)如果蒸发得到的固体中,只含NaClO3和NaCl,为得到比较纯的NaClO3溶液,结合下面各物质的溶解度与温度的关系,
其基本操作是:将固体溶于适量水,通过 , ,便可得到较纯的NaClO3溶液。
(4)工业上也常用石墨做电极,电解酸化的MnSO4溶液来制MnO2,则阳极上所发生的离子方程式 。
铁、铜单质及其化合物应用范围很广。现有含氯化亚铁杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按如图步骤进行提纯:
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见下表:
| |
Fe3+ |
Fe2+ |
Cu2+ |
| 氢氧化物开始沉淀时的pH |
1.9 |
7.0 |
4.7 |
| 氢氧化物完全沉淀时的pH |
3.2 |
9.0 |
6.7 |
请回答下列问题。
(1)加入氧化剂的目的是 。
(2)最适合作氧化剂X的是 。
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(3)加入的物质Y是 。
(4)若不用物质Y而是直接用碱能不能达到目的? (填“能”或“不能”)。若能,不用回答;若不能,试解释原因: 。
(5)最后能不能直接蒸发结晶得到CuCl2·2H2O晶体? (填“能”或“不能”)。若能,不用回答;若不能,回答该如何操作? 。
(6)若向溶液Ⅱ中加入碳酸钙,产生的现象是 。
(7)若向溶液Ⅱ中加入镁粉,产生的气体是 。试解释原因: 。
(8)FeCl3溶液具有净水作用的原因是 。
(10分)以Al(OH)3、H2SO4、工业(NH4)2SO4(含FeSO4)为原料制备透明氧化铝陶瓷的工艺流程如下:
回答下列问题:
(1)写出氧化步骤中发生的主要反应的离子方程式 。
(2)如何检验中和液中的杂质离子已完全除尽? 。
(3)固体NH4Al(SO4)2·12H2O[相对分子质量:453]在加热时,固体残留率随温度的变化如图所示。
633℃时剩余固体的成分化学式为 。
(4)综上分析,流程图中M的主要成分的化学式为 ,M可用一种物质吸收以实现循环利用,该物质的名称是 。
已知:硼镁矿主要成分为Mg2B2O5·H2O,硼砂的化学式为Na2B4O7·10H2O。利用硼镁矿制取金属镁及粗硼的工艺流程为:
回答下列有关问题:
(1)硼砂中B的化合价为 ,将硼砂溶于热水后,常用稀H2SO4调pH=2~3制取H3BO3,该反应的离子方程式为 。
(2)MgCl2·7H2O需要在HCl氛围中加热,其目的是 。若用惰性电极电解MgCl2溶液,其阴极反应式为 。
(3)镁-H2O2酸性燃料电池的反应原理为 Mg+H2O2+2H+===Mg2++2H2O, 则正极反应式为 。常温下,若起始电解质溶液pH=1,则当溶液pH=6时, (填“有”或“没有”)Mg(OH) 2沉淀析出。(已知Ksp[Mg(OH) 2]=5.6×10-12)。
(4)制得的粗硼在一定条件下生成BI3,BI3加热分解可以得到纯净的单质硼。现将0.020 g粗硼制成的BI3完全分解,生成的I2用0.30 mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液18.00 mL。该粗硼样品的纯度为__ __(提示:I2+2 ===2I-+
===2I-+ )(结果保留一位小数)。
)(结果保留一位小数)。
实验室里用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·H2O),过程如下:
请回答下列问题:
(1)写出过程①中FeS和O2、H2SO4反应的化学方程式: 。
(2)将过程②中产生的气体通入下列溶液中,溶液会腿色的是 。
| A.品红溶液 | B.紫色石蕊试液 | C.酸性高锰酸钾溶液 | D.溴水 |
(3)过程③中,需要加入的物质是 (化学式)。
(4)过程④中,蒸发结晶需要使用酒精灯、三角架、泥三角,还需要的仪器有 。
(5)过程⑥中,将溶液Z加热到70~80℃,目的是 。
硼和铝位于同一主族,它们可以形成许多组成和性质类似的化合物。一种用硼镁矿(Mg2B2O5·H2O)制取单质硼的工艺流程图如下: 
结合流程图回答下列问题:
(1)溶液a、溶液b中溶质的化学式分别为 . 。
(2)写出步骤①的化学方程式 。
(3)写出步骤②的离子方程式 。
(4)步骤③中化学反应可以发生的原因是 。
(5)过硼酸钠晶体(NaBO3·4H2O)是一种优良的漂白剂,在70℃以上加热会逐步失去结晶水。实验测得过硼酸钠晶体的质量随温度变化的情况如下图所示,则T2℃时所得晶体的化学式为 。 
以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等。实验室模拟工业以硫酸渣制备铁红(Fe2O3),过程如下:
(1)硫酸渣的成分中既能与酸又能与碱反应的是 ,写出酸溶过程Fe2O3与稀硫酸反应的离子反应方程式: 。
(2)生产过程中,为了确保铁红的纯度,氧化过程需要调节溶液的pH的范围是
(部分阳离子以氢氧化物形式沉淀时溶液的pH见下表)
| 沉淀物 |
Fe(OH)3 |
Al(OH)3 |
Fe(OH)2 |
Mg(OH)2 |
| 开始沉淀 |
2.7 |
3.8 |
7.5 |
9.4 |
| 完全沉淀 |
3.2 |
5.2 |
9.7 |
12.4 |
(3)滤渣A的主要成分为 ,滤液B含有的主要物质有 。
(4)如何证明洗涤环节充分洗净 。
(5)已知硫酸渣质量为a kg,假设铁红制备过程中铁元素损耗25%,最终得到铁红的质量为b kg,则原来硫酸渣中铁元素质量分数为 。(用题中所给数据列式并用最简整数比表示结果)
以铬铁矿(主要成分是FeO·Cr2O3,含少量MgCO3、Al2O3、SiO2等)为原料制取铬酸钠(Na2CrO4)晶体的工艺流程如下: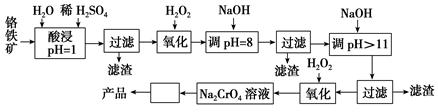
已知:①+3价Cr在酸性溶液中性质稳定,当pH>9时以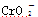 形式存在且易氧化;②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下。
形式存在且易氧化;②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下。
| 阳离子 |
Fe3+ |
Fe2+ |
Mg2+ |
Al3+ |
Cr3+ |
| 开始沉淀时的pH |
2.7 |
7.6 |
9.0 |
—— |
—— |
| 沉淀完全时的pH |
3.7 |
9.6 |
11.0 |
8 |
9(>9溶解) |
(1)流程中两次使用了H2O2,分别写出反应的离子方程式:__________________、_________________。
(2)加入NaOH调节溶液的pH=8时,被除去的离子是________;调节溶液的pH>11时,被除去的离子是________。
(3)“调pH=8”和“调pH>11”中间的“过滤”步骤不能省略,为什么?____________。
(4)流程图中 内的操作是______________________。
内的操作是______________________。
将磷肥生产中形成的副产物石膏(CaSO4·2H2O)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义。以下是石膏转化为硫酸钾和氯化钙的工艺流程示意图。
(1)本工艺中所用的原料除CaSO4·2H2O、KCl外,还需要 等原料
(2)写出石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式:
(3)过滤Ⅰ操作所得固体中,除CaCO3外还含有 (填化学式)等物质,该固体可用作生产水泥的原料。
(4)过滤Ⅰ操作所得滤液是(NH4)2SO4溶液。检验滤液中含有CO32-的方法是:____________ 。
(5)已知不同温度下K2SO4在100g水中达到饱和时溶解的量如下表:
| 温度(℃) |
0 |
20 |
60 |
| K2SO4溶解的量(g) |
7.4 |
11.1 |
18.2 |
60℃时K2SO4的饱和溶液591g冷却到0℃,可析出K2SO4晶体 g
(6)氯化钙结晶水合物(CaCl2·6H2O)是目前常用的无机储热材料,选择的依据是
a、熔点较低(29℃熔化) b、能导电 c、能制冷 d、无毒
(7)上述工艺流程中体现绿色化学理念的是:
试题篮
()