(16分)硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等。利用方铅矿精矿(PbS)直接制备硫酸铅粉末的流程如下: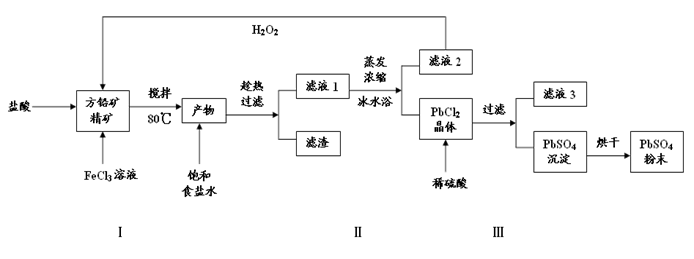
已知:(ⅰ)PbCl2(s)+2Cl-(aq) PbCl42- (aq) △H>0
PbCl42- (aq) △H>0
(ⅱ)Ksp(PbSO4)=1.08×10-8,Ksp(PbCl2)=1.6×10-5
(ⅲ)Fe3+、Pb2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、7.04
(1)步骤Ⅰ中FeCl3溶液与PbS反应生成PbCl2和S的离子方程式为 ,步骤Ⅰ中另一个反应是H2O2与FeCl2、盐酸反应生成FeCl3,实现FeCl3的重复利用,其离子方程式为 ,加入盐酸的另一个目的是为了控制pH在0.5~1.0,原因是 。
(2)用化学平衡移动的原理解释步骤Ⅱ中使用冰水浴的原因 。
(3)写出PbCl2晶体转化为PbSO4沉淀的离子方程式 。
(4)滤液3是 。
(5)铅蓄电池的电解液是稀硫酸(22%~28%),充电后两个电极上沉积的PbSO4分别转化为PbO2和Pb,铅蓄电池充电时阴极的电极反应式为 。
铬铁矿主要成分为FeO·Cr2O3,含有SiO2、Al2O3等杂质。工业上用铬铁矿制备红矾钠(Na2Cr2O7)的流程如下图所示:
煅烧时反应为:4 FeO·Cr2O3+7 O2 +20 NaOH 8 Na2CrO4 + 4 NaFeO2+10 H2O
8 Na2CrO4 + 4 NaFeO2+10 H2O
(1)步骤①是在坩埚中进行煅烧,可用作此坩埚材料的是 。
| A.铁 | B.氧化铝 | C.石英 | D.陶瓷 |
(2)步骤①煅烧反应极慢,需要升温至NaOH呈熔融状态,反应速率才加快,其原因为______。
(3)步骤②中NaFeO2会强烈水解生成氢氧化铁沉淀,其化学方程式为 。
(4)将五份滤液1分别在130℃蒸发1小时,各自冷却到不同温度下结晶,保温过滤,所得实验数据如下表。根据数据分析,步骤③的最佳结晶温度为___________。
(5)步骤④中滤渣3的成分是_________________________。
(6)假设该流程中铬元素完全转化为红矾钠,则该铬铁矿中铬元素的质量分数为_____(用含m1、m2的代数式表示)。
(15分)草酸镍晶体(NiC2O4•2H2O)可用于制镍催化剂,硫酸镍晶体(NiSO4•7H2O)主要用于电镀工业。某小组用废镍催化剂(成分为Al2O3、Ni、Fe、SiO2、CaO等)制备草酸镍晶体的部分实验流程如下:
已知:①相关金属离子生成氢氧化物沉淀的pH如下表(开始沉淀的pH按金属离子浓度为1.0 mol•L-1计算):
②Ksp(CaF2)= 1.46×10-10 Ksp(CaC2O4)= 2.34×10-9
(1)粉碎的目的是 。
(2)保持其他条件相同,在不同温度下对废镍催化剂进行“酸浸”,镍浸出率随时间变化如图
“酸浸”的适宜温度与时间分别为 (填字母)。
| A.30℃、30min | B.90℃、150min |
| C.70℃、120min | D.90℃、120min |
(3)证明“沉镍”工序中Ni2+已经沉淀完全的实验步骤及现象是 。
(4)将“沉镍”工序得到的混合物过滤,所得固体用乙醇洗涤、110℃下烘干,得草酸晶体。
①用乙醇洗涤的目的是 ;
②烘干温度不超过110℃的原因是 。
(5)由流程中的“浸出液”制备硫酸镍晶体的相关实验步骤如下:
第1步:取“浸出液”, ,充分反应后过滤,以除去铁、铝元素;
第2步:向所得滤液中加入适量NH4F溶液,充分反应后过滤,得“溶液X”;
第3步: ,充分反应后过滤;
第4步:滤渣用稍过量硫酸充分溶解后,蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得硫酸镍晶体。
①请补充完整相关实验步骤(可选试剂:H2SO4溶液、NaOH溶液、HNO3溶液、H2O2溶液)
②第2步中加入适量NH4F溶液的作用是 。
(12分)聚合硫酸铁铝(PFAS)是一种新型高效水处理剂。利用硫铁矿烧渣(主要成分为Fe3O4、FeO、SiO2等)为铁源、粉煤灰(主要成分为Al2O3、Fe2O3、FeO等)为铝源,制备PFAS的工艺流程如下:
(1)“碱溶”时,Al2O3发生反应的化学方程式为 。
(2)“酸溶Ⅱ”时,Fe3O4发生反应的离子方程式为 。
(3)“滤渣Ⅰ”、“滤渣Ⅱ”在本流程中能加以利用的是 。
(4)“氧化”时应控制温度不超过57℃,其原因是 。
(5)“氧化”时若用酸性高锰酸钾溶液代替,发生反应的离子方程式是 。
(6)酸度对絮凝效果和水质有显著影响。若产品中残留过多,使用时产生的不良后果是
(10分)碳酸铈[Ce2(CO3)3]为白色粉末,难溶于水,主要用作生产铈的中间化合物。它可由氟碳酸铈精矿经如下流程。
(1)氟碳酸铈的化学式为为CeFCO3,该化合物中,Ce的化合价为 。
(2)氧化焙烧生成的铈化合物为二氧化铈(CeO2),其在酸浸时发生反应的离子方程式为 。
(3)试剂X是 。
(4)若试剂X改为氢氧化钠溶液,则反应生成难溶物—一氢氧化铈(Ⅲ),其暴露于空气中时变成紫色,最终变成黄色的氢氧化高铈(Ⅳ)。氢氧化铈在空气中被氧化成氢氧化高铈的化学方程式为 。
(5)取(4)中得到的Ce(OH)4产品(质量分数为97%)1. 00 g,加硫酸溶解后,用0.1000mol·L-1的FeSO4溶液滴定至终点(铈被还原成Ce3+),则需要滴加标准溶液的体积为 mL。
锂被誉为“金属味精”,以LiCoO2为正极材料的锂离子电池已被广泛用作便携式电源。工业上常以β锂辉矿(主要成分为LiAlSi2O6,还含有FeO、MgO、CaO等杂质)为原料来制取金属锂。其中一种工艺流程如下:
已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
| 氢氧化物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
| 开始沉淀pH |
2.7 |
3.7 |
9.6 |
| 完全沉淀pH |
3.7 |
4.7 |
11 |
②Li2CO3在不同温度下的溶解度如下表:
| 温度/℃ |
0 |
10 |
20 |
50 |
75 |
100 |
| Li2CO3的溶解度/g |
1.539 |
1.406 |
1.329 |
1.181 |
0.866 |
0.728 |
请回答下列问题:
(1)用氧化物形式表示LiAlSi2O6的组成:__________________________。
(2)反应Ⅱ加入碳酸钙的作用是__________________________________。
(3)写出反应Ⅲ中生成沉淀A的离子方程式:________________________。
(4)洗涤所得Li2CO3沉淀要使用________(选填“热水”或“冷水”),你选择的理由是__________________________________。
(5)电解熔融氯化锂生产锂时,阳极产生的氯气中会混有少量氧气,原因是
________________________________________。
(选做15分)硫酸铁铵[aFe2(SO4) 3·b(NH4) 2SO4·cH2O]广泛用于城镇生活饮用水、工业循环水的净化处理等。某化工厂以硫酸亚铁(含少量硝酸钙)和硫酸铵为原料,设计了如下工艺流程制取硫酸铁铵。
请回答下列问题:
(1)下列物质中最适合的氧化剂B是 ;
a.NaClO b.H2O2 c.KMnO4 d.K2Cr2O7
反应的离子方程式 。
(2)上述流程中,用足量最适合的氧化剂B氧化之后和加热蒸发之前,需取少量检验Fe2+是否已全部被氧化,能否用酸性的KMnO4溶液? 并说明理由 。(可用文字或方程式说明)
(3)检验硫酸铁铵中NH4+的方法是 。
(4)称取14.00 g所得样品,将其溶于水配制成100 mL溶液,分成两等份,向其中一份中加入足量 NaOH溶液,过滤洗涤得到2.14 g沉淀;向另一份溶液中加入含0.05 mol Ba (NO3)2的溶液,恰好完 全反应。则该硫酸铁铵的化学式为______________________
 新型锂离子电池在新能源的开发中占有重要地位。可用作节能环保电动汽车的动力电池。磷酸亚铁锂(LiFePO4)是新型锂离子电池的首选电极材料,它的制备方法如下:
新型锂离子电池在新能源的开发中占有重要地位。可用作节能环保电动汽车的动力电池。磷酸亚铁锂(LiFePO4)是新型锂离子电池的首选电极材料,它的制备方法如下: 方法一:将碳酸锂、乙酸亚铁[(CH3COO)
方法一:将碳酸锂、乙酸亚铁[(CH3COO) Fe]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其它产物均以气体逸出。
Fe]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其它产物均以气体逸出。 方法二:将一定浓度的磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出磷酸亚铁锂沉淀。沉淀经过滤、洗涤、干燥,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂。
方法二:将一定浓度的磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出磷酸亚铁锂沉淀。沉淀经过滤、洗涤、干燥,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂。 在锂离子电池中,需要一种有机聚合物作为正负极之间锂离子迁移的介质,该有机聚合物的单体之一(用M表示)的结构简式如下:
在锂离子电池中,需要一种有机聚合物作为正负极之间锂离子迁移的介质,该有机聚合物的单体之一(用M表示)的结构简式如下:

 请回答下列问题:
请回答下列问题: (1)上述两种方法制备磷酸亚铁锂的过程都必须在惰性气体氛围中进行。其原因是
(1)上述两种方法制备磷酸亚铁锂的过程都必须在惰性气体氛围中进行。其原因是 。
。 (2)在方法一所发生的反应中, 除生成磷酸亚铁锂、乙酸外,还有 、
(2)在方法一所发生的反应中, 除生成磷酸亚铁锂、乙酸外,还有 、 、 (填化学式)生成。
、 (填化学式)生成。 (3)在方法二中,阳极生成磷酸亚铁锂的电极反应式为
(3)在方法二中,阳极生成磷酸亚铁锂的电极反应式为 。
。 (4)写出M与足量氢氧化钠溶液反应的化学方程式:
(4)写出M与足量氢氧化钠溶液反应的化学方程式: 。
。 (5)已知该锂离子电池在充电过程中,阳极的磷酸亚铁锂生成磷酸铁,则该电池放电时正极的电极反应式为
(5)已知该锂离子电池在充电过程中,阳极的磷酸亚铁锂生成磷酸铁,则该电池放电时正极的电极反应式为 。
。
钡盐行业生产中排出大量的钡泥,主要含有BaCO3、BaSiO3、BaSO3、Ba(FeO2)2等。某主要生产BaCl2、BaCO3、BaSO4的化工厂利用钡泥制取Ba(NO3)2,其部分工艺流程如下(已知溶液中Fe3+沉淀完全的pH=3.7):
(1)酸溶后溶液中pH=1,Ba(FeO2)2与HNO3的反应化学方程式为 。
(2)酸溶时通常控制反应温度不超过70℃,且不使用浓硝酸,原因是 。
(3)该厂结合本厂实际,选用的X为 (填化学式);中和Ⅰ使溶液中 (填离子符号)的浓度减少(中和Ⅰ引起的溶液体积变化可忽略)。
【化学——选修2:化学与技术】
锂电池在人们生产生活中的应用十分广泛,其消耗量巨大,对不可再生的金属资源造成了相当大的消耗。因此,锂离子的电池回收具有重要的意义。其中需要重点回收的是正极材料,其主要成分为钴酸锂( LiCoO2)、导电乙炔黑(一种炭黑)、铝箔以及有机粘接剂:
某工厂的回收工艺流程如下:
(1)上述工艺回收到的产物有 。
(2)废旧电池可能由于放电不完全而残留有原子态的锂,为了安全对拆解环境的要求是 。
(3)滤液用稀硫酸调pH时反应的离子方程式为 。
(4)酸浸时反应的化学方程式为 。如果用盐酸代替H2SO4和H2O2混合液中的H2SO4也能达到溶解的目的,但不利之处是 。
(5)生成Li2CO3的化学反应方程式为 。已知Li2CO3在水中的溶解度随着温度升高而减小,最后一步过滤时应该 。
钛及其化合物大量应用于航空、造船、电子、化学、医疗器械、电讯器材等各个领域。由钛铁矿(FeTiO3)提取金属钛(海绵钛)的主要工艺流程如下(部分产物省略):
(1)氯化的过程是将二氧化钛、碳粉混合,在高温条件下通入氯气制得TiCl4和一种可燃性气体,该反应的化学方程式为 ;TiCl4在室温下为无色液体,氯化后提纯四氯化钛的方法是过滤、____ 。
(2)还原过程是用过量的镁在高温条件下与TiCl4反应制得海绵钛。写出此反应的化学方程式 。
(3)还原过程必须在1070 K的温度下进行,你认为还应该控制的反应条件是 。
(4)常温下,钛不与水、稀盐酸、稀H2SO4或稀HNO3作用,但易溶于氢氟酸,推测其原因是 。
| A.氢氟酸的酸性比其他酸强 |
| B.氢氟酸的氧化性比其他酸强 |
| C.氢氟酸的还原性比其他酸强 |
| D.钛离子易与氟离子形成可溶性难电离物质 |
(5)上述工艺中,得到的海绵钛中可能含有金属镁,常温下除去该杂质应选用的试剂是稀盐酸或稀硫酸,不选择稀硝酸的原因是__ __;若杂质只有金属镁的某海绵钛样品,去除杂质后质量减少十分之一,则该样品中n(Ti):n(Mg)= 。
(15分)三氯氧磷(POCl3)无色液体,易水解。用于制取染料中间体,有机合成的氯化剂和催化剂,阻燃剂。还常用作半导体掺杂剂及光导纤维原料。氯化水解法生产三氯氧磷的流程如下:

(1)在反应釜中氯化水解法生产三氯氧磷的化学方程式为 。反应中应控制氯气和水的质量比为3.94,若质量比过小,会导致三氯氧磷产率降低,试分析原因 。
(2)经吸收塔吸收后得到副产品,副产品为 (写名称)。
(3)通过佛尔哈德法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
Ⅰ.取a g产品于锥形瓶中,加入足量NaOH溶液,待完全水解后加稀硝酸至酸性。
Ⅱ.向锥形瓶中加入0.1000 mol·L-1的AgNO3溶液40.00 mL,使Cl-完全沉淀。
Ⅲ.向其中加入2 mL硝基苯,用力摇动,使沉淀表面被有机物覆盖。
Ⅳ.加入指示剂,用c mol·L-1NH4SCN溶液滴定过量Ag+至终点,记下所用体积。
已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12
①滴定选用的指示剂是 (选填字母),滴定终点的现象为 。
a.FeCl2 b.NH4Fe(SO4)2 c.淀粉 d.甲基橙
②实验过程中加入硝基苯的目的是 ,如无此操作所测Cl元素含量将会 (填“偏大”、“偏小”或“不变”)
(4)氯化水解法生产三氯氧磷会产生含磷(主要为H3PO4、H3PO3等)废水,某研究小组想把含磷废水中磷元素转化为磷酸钙沉淀除去,实验操作为 。
可选用的试剂:漂白粉 生石灰 氯化
| |
最佳沉淀pH |
| 磷酸氢钙 |
7.0——7.6 |
| 磷酸钙 |
9.0——11 |
Ba(OH)2是重要的化工原料,工业上采用重晶石(主要成分为硫酸钡)和软锰矿(主要成分为二氧化锰,含有二氧化硅杂质)制备,同时得到碳酸锰等副产品。其工业流程如下:

已知:MnO2为两性氧化物,MnO为碱性氧化物。
(1)高温还原过程中,硫酸钡被碳还原为BaS,然后水浸得到。投料时煤炭的量相对要多其作用除了使硫酸钡充分反应外,还有 。
(2)氧化时反应还生成MnO和一种固体产物,则该反应的化学方程式为 ,氧化时控制MnO2与BaS的投料比在2~3之间,若投料比大于4,则Ba(OH)2的转化率明显降低,原因可能是
(3)酸化的离子反应方程式为 ,滤渣的主要成分为 。
(4)中和时通入氨气调节溶液的pH值,若pH值偏高,会造成碳酸锰不纯,原因是 。
某合作学习小组的同学拟用硼砂制取硼酸并测定硼酸样品的纯度。制备硼酸的实验流程如下:
(1)溶解硼砂时需要的玻璃仪器有:烧杯和 。
(2)用pH试纸测定溶液pH的操作方法为 。
(3)用盐酸酸化硼砂溶液生成硼酸的离子方程式为 。
(4)实验流程中缺少的步骤a、步骤b操作分别为 、 。
(5)硼酸酸性太弱不能用碱的标准溶液直接滴定,实验室常采用间接滴定法,其原理为:
滴定步骤为:
①滴定到终点时溶液颜色变化是 。
②若滴定到终点时消耗NaOH标准溶液22.00mL,则本次滴定测得的硼酸样品中硼酸的质量分数为 (假定杂质不反应)。
③若滴定时滴定管尖嘴部分有气泡,滴定过程中消失,将导致测得的结果 (选填:“偏大”、“偏小”或“不变”)。
氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2•6H2O的流程如下: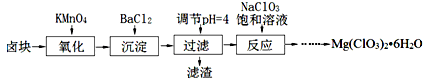
已知:
①卤块主要成分为MgCl2•6H2O,含有MgSO4、FeCl2等杂质。
②四种化合物的溶解度(S)随温度(T)变化曲线如图所示。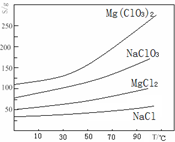
(1)“调节pH=4”可选用的试剂是 (填编号)。
①MgO ②CuO ③MgCO3 ④Mg
(2)加入BaCl2的目的是除去杂质离子,检验杂质离子已沉淀完全的方法是 。
(3)“滤渣”的主要成分为 。
(4)加入NaClO3饱和溶液发生反应为:MgCl2+2NaClO3═===Mg(ClO3)2+2NaCl,再进一步制取Mg(ClO3)2•6H2O的实验步骤依次为:①蒸发、浓缩、结晶;② ;③ ;④过滤、洗涤、干燥。
(5)将产品先用水洗涤,再用无水乙醇清洗。无水乙醇的作用是 。
(6)产品中Mg(ClO3)2•6H2O含量的测定:
步骤1:准确称量3.00g产品配成100mL溶液。
步骤2:取10mL于锥形瓶中,加入10mL稀硫酸和20mL 1.000mol•L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100mol•L-1 K2Cr2O7溶液滴定至终点,此过程中反应的离子方程式为:
Cr2O72-+6Fe2++14H+===2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00mL。
①写出步骤2中发生反应的离子方程式: 。
②产品中Mg(ClO3)2•6H2O的质量分数为 。
试题篮
()