MgSO4•7H2O在医药上常用做泻药,工业上可用氯碱工业中的一次盐泥为原料生产。已知一次盐泥中含有镁、钙、铁、铝、锰的硅酸盐和碳酸盐等成分。其主要工艺如下:
用H2SO4调节溶液PH至1~2,H2SO4作用是 。
(2)加NaClO溶液至PH=5~6并加热煮沸5~10分钟,沉淀2中主要含有MnO2和另外两种难溶物,这两种难溶物的化学式分别为 、 ;其中NaClO溶液将MnSO4转化为MnO2的离子方程式为 。
(3)检验滤液Ⅱ中是否含有Fe3+的实验方法是 。
(4)“操作X”是将溶液 、 、过滤洗涤,即得到MgSO4•7H2O晶体。
(5)准确称量制得的样品5g,用200mL水溶解,加入2 mol•L—1的盐酸5mL,在不断搅拌下滴加足量2 mol•L—1 BaCl2溶液,充分反应后,得沉淀4.46g,则样品纯度为 。
实验室可以用MgCl2•6H2O为原料制备碳酸镁晶须,主要流程如下: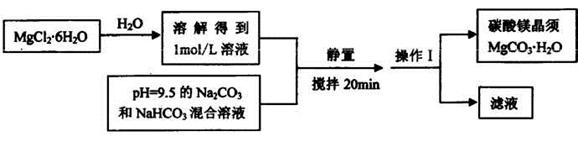
试回答:
(1)操作1的名称是_______。
(2)上述反应过程要控制好温度,因为MgCO3置于水中长时间加热煮沸可完全生成Mg(OH)2,其原因是_____________________。
(3)另査阅文献,在加热煮沸时也可能生成碱式碳酸镁Mg5(OH)2(CO3)4·4H2O,写出该反应的化学方程式______________。
(4)某课题组为了确定MgCO3在水中长时间加热煮沸后所得的固体成分,进行如下研究。(注:Mg(OH)2, Mg5(OH)2(CO3)4.4H2O在煮沸时均不会分解)
①定性研究:请你完成下表中内容。
| 实验步骤 |
预期的实验现象和结论 |
| 取一定质量的固体样品 |
若 ,则固体产物为Mg(OH)2 |
②另取一定质量的固体,灼烧至恒重,能否通过固体质量的减少量来确定固体的成分?_______ (填“能”或“否”),理由是______________
用霞石岩(主要成份Na2O、K2O、Al2O3、SiO2)制碳酸钠、碳酸钾和氧化铝的工艺流程如下:
已知:NaHCO3溶液的pH约为8~9,Na2CO3溶液的pH约为11~12。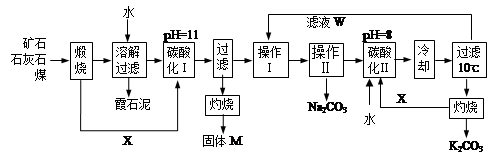
溶解过滤工序产生的滤液中含钠、钾和铝的可溶性盐类,钙和硅等其他杂质在滤渣霞石泥中。部分物质的溶解度见图,根据题意回答下列问题: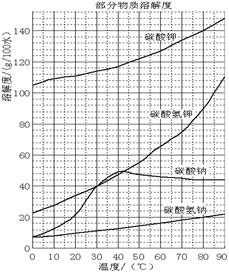
(1)固体M的化学式是__________, X物质是___________。
(2)实验室进行煅烧操作时盛放固体物质的实验仪器是 __________,滤液W中主要含有的离子有__________________。
(3)碳酸化Ⅰ中发生主要反应的离子方程式是_______________________________________。
(4)操作Ⅰ是_________(填写名称),操作Ⅱ是 _______(选填编号)。
a.趁热过滤 b.冷却过滤 c.蒸馏 d.灼烧
(5)碳酸化Ⅱ调整pH=8的目的是____________________,产品K2CO3中最可能含有的杂质是________(写化学式)。
(6)实验室用下面流程测定产品碳酸钾的纯度,为提高实验精度,T试剂最好是____________;操作Ⅲ的名称是_______________。
碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病,KI、K1O3曾先后用于加碘盐中。
(1)工业上可以通过铁屑法生产KI,其工艺流程如下: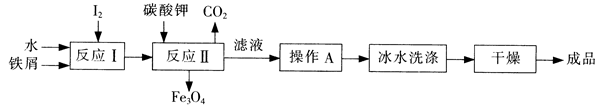
①反应I生成铁与碘的化合物,若该化合物中铁元素与碘元素的质量比为21:127,则加入足量碳酸钾时,反应Ⅱ的化学方程式为 。
②操作A包括 ;用冰水洗涤的目的是 。
(2)KIO3可以通过H2O2氧化I2先制得HIO3,然后再用KOH中和的方法进行生产。
①烹饪时,含KIO3的食盐常在出锅前加入,其原因是 ,
②若制得1284 kg KIO3固体,理论上至少需消耗质量分数为30%的双氧水 kg。
③KIO3还可通过下图所示原理进行制备。电解时总反应的离子方程式为 。若忽略溶液体积的变化,则电解结束后阴极区的pH与电解前相比 (选填“增大”、“减小”或“不变”)。
锶(Sr)为第五周期ⅡA族元素。高纯六水氯化锶晶体(SrCl2•6H2O)具有很高的经济价值,61℃时晶体开始失去结晶水,100℃时失去全部结晶水。用工业碳酸锶粉末(含少量Ba、Fe的化合物)制备高纯六水氯化锶的过程如下图: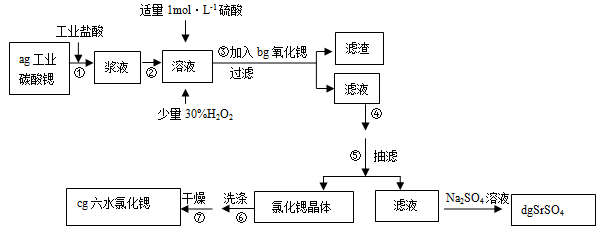
请回答:
(1)加入少量30%H2O2的作用 (用离子方程式表示);
(2)步骤③中氧化锶粉末的作用是 ,工业上用50~60℃热风吹干六水氯化锶,选择该温度的原因是 ;
(3)步骤④进行的实验操作为 、 ,步骤⑥中,洗涤氯化锶晶体最好选用 ;
| A.水 | B.硫酸 | C.氢氧化钠溶液 | D.氯化锶饱和溶液 |
(4)指出下图中仪器b 的名称 , 在抽滤时使滤纸紧贴布氏漏斗瓷板的操作是 ,抽气使滤纸紧贴在漏斗瓷板上;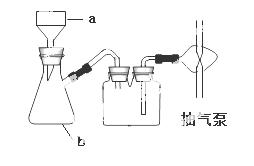
(5)计算原工业碳酸锶粉末中碳酸锶的质量分数 (列计算式即可)。
明矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O,还含有少量Fe2O3杂质。利用明矾石制备氢氧化铝的流程如下: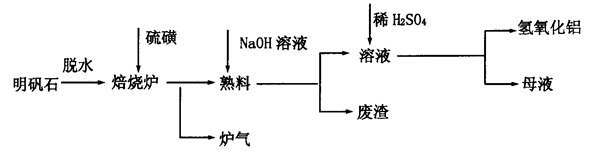
(1)焙烧炉中发生反应的化学方程式为2Al2(SO4)3+3S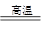 2Al2O3+9SO2,该反应的氧化剂是_______。若生成l molAl2O3,则转移的电子数为__________________。
2Al2O3+9SO2,该反应的氧化剂是_______。若生成l molAl2O3,则转移的电子数为__________________。
(2)熟料溶解时,反应的离子方程式为___________________________________________。
(3)母液中溶质主要成分的化学式为_____________________________________________。
(4)将标准状况下1.12L炉气通入100mL 0.5mol·L-1NaOH溶液中,得到一种酸性溶液,则该溶液中各种离子浓度由大到小的排列顺序为____________________________。
(5)检验废渣中主要成分的方法是_____________________________________________________(写出操作步骤、现象及结论)。
废旧物的回收利用既有利于节约资源,又有利于保护环境。某研究小组同学以废旧锌锰干电池为原料,将废旧电池含锌部分转化成ZnSO4·7H2O,含锰部分转化成纯度较高的MnO2,将NH4Cl溶液应用于化肥生产中,实验流程如下: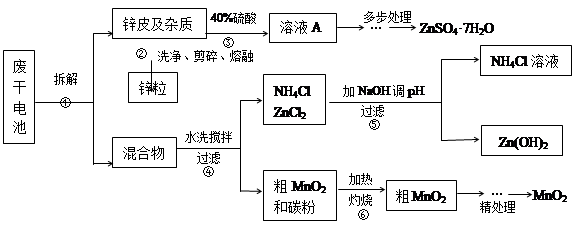
(1)操作②中所用的加热仪器应选 (选填“蒸发皿”或“坩埚”)。
(2)将溶液A处理的第一步是加入氨水调节pH为9,使其中的Fe3+和Zn2+沉淀,请写出氨水和Fe3+反应的离子方程式 。
(3)操作⑤是为了除去溶液中的Zn2+。已知25℃时,
| NH3·H2O的Kb |
Zn2+完全沉淀的pH |
Zn(OH)2溶于碱的pH |
| 1.8×10-5 |
8.9 |
>11 |
由上表数据分析应调节溶液pH最好为 (填序号)。
a.9 b.10 c.11
(4) MnO2精处理的主要步骤:
步骤1:用3%H2O2和6.0mol/L的H2SO4的混和液将粗MnO2溶解,加热除去过量H2O2,得MnSO4溶液(含少量Fe3+)。反应生成MnSO4的离子方程式为 ;
步骤2:冷却至室温,滴加10%氨水调节pH为6,使Fe3+沉淀完全,再加活性炭搅拌,抽滤。加活性炭的作用是 ;
步骤3:向滤液中滴加0.5mol/L的Na2CO3溶液,调节pH至7,滤出沉淀、洗涤、干燥,灼烧至黑褐色,生成MnO2。灼烧过程中反应的化学方程式为 。
(5) 查文献可知,粗MnO2的溶解还可以用盐酸或者硝酸浸泡,然后制取MnCO3固体。
①在盐酸和硝酸溶液的浓度均为5mol/L、体积相等和最佳浸泡时间下,浸泡温度对MnCO3产率的影响如图4,由图看出两种酸的最佳浸泡温度都在 ℃左右;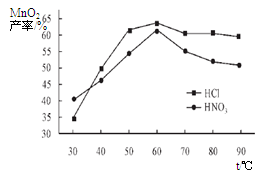
②在最佳温度、最佳浸泡时间和体积相等下,酸的浓度对MnCO3产率的影响如图5,由图看出硝酸的最佳浓度应选择 mol/L左右。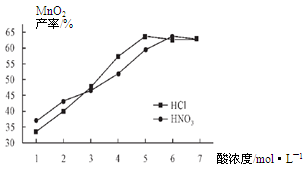
金属锂是原子能工业和新能源工业中的重要物质。工业上常用β—辉锂矿(主要成分是LiAlSi2O6,含有少量钙、镁杂质)制备金属锂,其生产流程如下: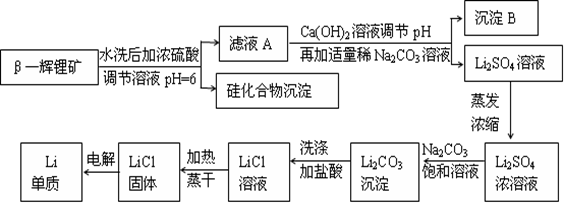
已知Li2CO3微溶于水。请回答下列问题:
(1)写出LiAlSi2O6与硫酸反应的化学方程式_______________________。
(2)沉淀B的主要成分是_____________(写化学式)。
(3)蒸发浓缩Li2SO4溶液时,需要使用的硅酸盐质仪器有蒸发皿、_________和_________。
(4)上述生产流程中蒸发浓缩Li2SO4溶液的目的是____________________。
(5)金属锂用于锂电池时,常用FeF3作其正极的活性物质,FeF3常用FeCl3与40%HF溶液反应制备。在制备过程中需要选用特制聚四氟乙烯材料的容器进行反应,而不是用普通的玻璃仪器或陶瓷仪器,其原因是_________________________________(用化学反应方程式表示)。
(6)金属锂可用于储存氢气,其原理是:①2Li+H2=2LiH,②LiH+H2O=LiOH+H2↑。若已知LiH的密度为0.82g·cm-3,用金属锂吸收224L H2(标准状况)恰好完全反应,则生成的LiH的体积与被吸收的氢气的体积之比为1: ______(精确到整数)。
K2SO4是无氯优质钾肥,Mn3O4是生产软磁铁氧体材料的主要原料。以硫酸工业的尾气联合制备K2SO4和Mn3O4的工艺流程如下:
(1)几种盐的溶解度见图。反应III中,向(NH4)2SO4溶液中加入KCl溶液充分反应后,进行蒸发浓缩、 、洗涤、干燥等操作即得K2SO4产品。
(2)检验K2SO4样品是否含有氯化物杂质的实验操作是: 。
(3)反应IV的化学方程式为 。
(4)Mn3O4与浓盐酸加热时发生反应的离子方程式为 。
(5)下图是煅烧MnSO4•H2O时温度与剩余固体质量变化曲线。
①该曲线中B段所表示物质的化学式为 。
②煅烧过程中固体锰含量随温度的升高而增大,但当温度超过1000℃时,再冷却后,测得产物的总锰含量反而减小。试分析产物总锰含量减小的原因: 。
医用氯化钙可用于补钙、抗过敏和消炎等,以工业碳酸钙(含少量Na+、Al3+、Fe3+等杂质)生产医用二水合氯化钙工艺流程为: 
已知:查阅资料得知氢氧化物沉淀时的pH为:
| 氢氧化物 |
Fe(OH)3 |
Al(OH)3 |
|
| 开始沉淀时的pH |
2.3 |
4.0 |
开始溶解:7.8 |
| 完全沉淀时的pH |
3.7 |
5.2 |
完全溶解:10.8 |
(1)CaCO3与盐酸反应的离子方程式 。
(2)除杂操作是加入氢氧化钙,调节溶液的pH为 ,目的是除去溶液中少量的Al3+、Fe3+。检验Fe(OH)3是否沉淀完全的实验操作是
。
(3)过滤时需用的玻璃仪器有 。滤渣主要成分的化学式 。
(4)酸化时加盐酸的目的为:① ,②防止Ca2+ 在蒸发时发生水解。
(5)为什么蒸发结晶要保持在160℃: 。
(6)测定晶体样品的纯度:若用一定浓度的AgNO3溶液滴定一定质量的晶体样品,所测样品中CaCl2 ·2H2O的质量分数偏高(忽略其它实验误差),可能的原因之一为 。
钡盐生产中排出大量的钡泥[主要含BaCO3、BaSO3、Ba(FeO2)2等],某主要生产BaCO3的化工厂利用钡泥制取Ba(NO3)2晶体及其他副产物,其部分工艺流程如下:
已知:① Fe(OH)3和Fe(OH)2完全沉淀时,溶液的pH分别为3.2和9.7
② Ba(NO3)2在热水中溶解度较大,在冷水中溶解度较小
③ KSP(BaSO4)=1.1×10-10,KSP (BaCO3)=5.1×10-9
(1)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量的饱和Na2CO3溶液中,充分搅拌,过滤,洗涤。用离子方程式说明提纯原理: 。
(2)上述流程酸溶时,Ba(FeO2)2与HNO3反应生成两种硝酸盐,化学方程式为:
。
(3)该厂结合本厂实际,选用的X为 ;
| A.BaCl2 | B.BaCO3 | C.Ba(NO3)2 | D.Ba(OH)2 |
(4)废渣2为 。
(5)操作III为 。
(6)过滤3后的母液应循环到容器 中。(填“a”、“b”或“c”)
(7)称取w克晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量沉淀质量为m克,则该Ba(NO3)2的纯度为 (相对分子质量:Ba(NO3)2为261,BaSO4为233)。
钒及化合物用途广泛。工业上常用含少量Al2O3的钒铁矿(FeO×V2O5)碱熔法提取V2O5。简要工艺流程如下:
已知:①焙烧时可发生反应:V2O5+Al2O3+2Na2CO3 2NaVO3+2NaAlO2+2CO2↑
2NaVO3+2NaAlO2+2CO2↑
②常温下物质的溶解度:NaVO3~21.2 g /100g水;HVO3~0.008 g/100g水
(1)“浸出渣B”的主要成分是 。(写化学式)
(2)生产中,不直接用H2SO4浸泡“烧渣A”获取HVO3的原因是 。
(3)“操作①”包括 、洗涤。如果不洗涤,则产品中可能含有的金属阳离子是 、 。下列装置(部分夹持仪器省去)可用在实验室进行“操作②”的是 。(填序号)
A B C D
(4)NaVO3用于原油的脱硫技术,由V2O5溶于NaOH溶液中制取,反应的离子方程式为 。
(5)V2O5还可用于将硅铁炼成钒铁。生产中加入CaO可节能减排。有关反应如下:
2V2O5(l)+ 5Si(s)+ 5CaO(s)=" 4V(s)+" 5CaSiO3(s) △H1 =" —2096.7" kJ/mol
已知:CaSiO3(s)=" CaO(s)+" SiO2(s) △H2 =" +92.5" kJ/mol
则:2V2O5(l)+ 5Si(s)=" 4V(s)+" 5SiO2(s) △H3 = 。
重铬酸钠(Na2Cr2O7•2H2O)俗称红矾钠,在工业方面有广泛用途.我国目前主要是以铬铁矿(主要成份为FeO•Cr2O3,还含有Al2O3、MgO、SiO2等杂质)为主要原料进行生产,其主要工艺流程如下: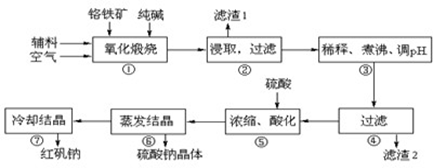
中涉及的主要反应有:
主反应:4FeO•Cr2O3+8Na2CO3+7O2  8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
副反应: SiO2+Na2CO3 Na2SiO3+CO2↑ Al2O3+Na2CO3
Na2SiO3+CO2↑ Al2O3+Na2CO3 2NaAlO2+CO2↑
2NaAlO2+CO2↑
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Mg(OH)2 |
Cr(OH)3 |
| 完全沉淀时溶液pH |
4.7 |
3.7 |
11.2 |
5.6 |
试回答下列问题:
(1)“①”中反应是在回转窑中进行,反应时需不断搅拌,其作用是 ;
(2)“③”中调节pH至4.7,目的是 ;
(3)“⑤”中加硫酸酸化的目的是使CrO42-转化为Cr2O72-,请写出该平衡转化的离子方程式: ;
(4)称取重铬酸钠试样2.5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL 2mol•L-1H2SO4和足量碘化钠(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol•L-1Na2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)
①判断达到滴定终点的依据是: 。
②若实验中共用去Na2S2O3标准溶液40.00ml,所得产品的中重铬酸钠的纯度 (设整个过程中其它杂质不参与反应) 。
二氧化铈 是一种重要的稀土氧化物.。平板电视显示屏生产过程中产生大量的废玻璃粉末(含
是一种重要的稀土氧化物.。平板电视显示屏生产过程中产生大量的废玻璃粉末(含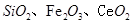 以及其他少量可溶于稀酸的物质)。某课题组以此粉末为原料回收铈,设计实验流程如下:
以及其他少量可溶于稀酸的物质)。某课题组以此粉末为原料回收铈,设计实验流程如下:
(1)洗涤滤渣A的目的是为了去除 (填离子符号),检验该离子是否洗净的方法是 。
(2)第②步反应的离子方程式是 ,滤渣B的主要成分是 。
(3)萃取是分离稀土元素的常用方法,已知化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,TBP (填“能”或“不能”)与水互溶。实验室进行萃取操作是用到的主要玻璃仪器有 、烧杯、玻璃棒、量筒等。
(4)取上述流程中得到的
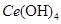 产品0.536g,加硫酸溶解后,用0.1000mol•
产品0.536g,加硫酸溶解后,用0.1000mol• 溶液(铈被还原为
溶液(铈被还原为 ),消耗25.00mL溶液,该产品中
),消耗25.00mL溶液,该产品中 的质量分数为 。
的质量分数为 。
二氧化铈()是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含
、
、
以及其他少量可溶于稀酸的物质)。某课题组以此粉末为原料回收铈,设计实验流程如下:

(1)洗涤滤渣的目的是为了去除(填离子符号),检验该离子是否洗涤的方法是
(2)第②步反应的离子方程式是,滤渣B的主要成分是。
(3)萃取是分离稀土元素的常用方法,已知化合物作为萃取剂能将铈离子从水溶液中萃取出来,
(填"能"或"不能")与水互溶。实验室进行萃取操作是用到的主要玻璃仪器有、烧杯、玻璃棒、量筒等。
(4)取上述流程中得到的产品0.536
,加硫酸溶解后,用0.1000
标准溶液滴定终点是(铈被还原为
),消耗25.00
标准溶液,该产品中
的质量分数为。
试题篮
()