甲乙两种非金属:①甲比乙容易与H2化合;②甲的氢化物比乙的氢化物稳定③
甲的最高价氧化物对应的水化物的酸性比乙的最高价氧化物对应的水化物酸性强;
④与某金属反应时甲原子得电子数目比乙的多;⑤甲的单质熔沸点比乙的低。能说
明甲比乙的非金属性强的是
| A.只要④ | B.只有⑤ | C.①②③④⑤ | D.①②③ |
已知反应3Cl2 + 6NaOH="5NaCl" + NaClO3 + 3H2O下列说法正确的是 ( )
| A.NaCl是氧化产物,NaClO3是还原产物 | B.该反应中的电子转移数目为6e- |
| C.氧化剂和还原剂的质量比是1:5 | D.Cl2既是氧化剂也是还原剂 |
航天技术测得三氧化二碳(C2O3)是金星大气层的成份之一,下列关于C2O3的说法中错误的是
| A.C2O3与CO2都是碳的氧化物 | B.C2O3与CO2都是碳酸的酸酐 |
| C.C2O3与CO都具有还原性 | D.C2O3与C的燃烧产物都是CO2 |
从海水中提取溴的过程中涉及到反应:Br2 + SO2 + 2H2O =" 2HBr" + H2SO4,下列说法正确的是
| A.Br2在反应中被氧化 |
| B.SO2在反应中表现还原性 |
| C.H2SO4是还原产物 |
| D.1 mol氧化剂在反应中失去2 mol电子 |
物质在反应中可表现氧化性、还原性、酸性、碱性等,下面反应的划线物质中,能在同一反应中同时表现上述两种或两种以上性质的有( )
①3FeO+10HNO3==3Fe(NO3)3+NO↑+5H2O ②C+2H2SO4(浓)==CO2↑+2SO2↑+2H2O
③8NH3+3Cl2==6NH4Cl+N2 ④NaH+H2O==NaOH+H2↑ ⑤2Na2O2+2H2O==4NaOH+O2↑
| A.仅有①② | B.仅有①③④⑤ | C.仅有①③⑤ | D.全部 |
根据下列反应判断有关物质还原性由强到弱的顺序是
H2SO3+I2+H2O===2HI+H2SO4
2FeCl3+2HI===2FeCl2+2HCl+I2
3FeCl2+4HNO3===2FeCl3+NO↑+2H2O+Fe(NO3)3
| A.H2SO3>I->Fe2+>NO | B.I->Fe2+>H2SO3>NO |
| C.Fe2+>I->H2SO3>NO | D.NO>Fe2+>H2SO3>I- |
已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2氧化性依次减弱,下列反应在水溶液中不可能发生的是( )
| A.3Cl2+6FeI2=2FeCl3+4FeI3 |
| B.Cl2+2FeI2=FeCl2+I2 |
| C.Co2O3+6HCl=CoCl3+Cl2↑+3H2O |
| D.2Fe3++2I-=2Fe2++I2 |
氯和硫都是重要的非金属元素。下列叙述不能说明氯的非金属性比硫强的是
| A.氯化氢的沸点比硫化氢的沸点高 | B.与氢气反应时,氯气比硫更容易 |
| C.氯气可以从氢硫酸溶液中置换出硫 | D.高氯酸(HClO4)的酸性比H2SO4强 |
金属镍有广泛的用途。粗镍中含有少量Fe、Cu、Pt等杂质,可用电解法制备高纯度的镍(用NiSO4作电解质溶液)。已知:氧化性Fe2+<Ni2+<Cu2+,下列叙述正确的是
| A.阳极发生还原反应,其电极反应式:Ni2+2e=Ni |
| B.电解过程中,阳极质量的减少与阴极质量的增加相等 |
| C.电解后,溶液中存在的金属阳离子只有Fe2+ |
| D.电解后,可以从电解槽底部的阳极泥中回收Cu和Pt |
常温下,在下列溶液中发生如下反应: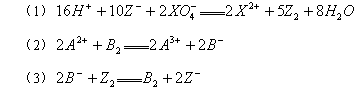
由此判断,下列说法错误的是
A.溶液中不可能发生反应 |
| B.Z2元素在(1)(3)反应中均做还原剂 |
C.氧化性由强到弱顺序是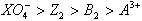 |
| D.X2+是XO4还原产物 |
制备单质硅时,主要化学反应如下
①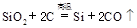 ②
② ③
③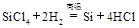 下列对上述三个反应的叙述中,不正确的是( )
下列对上述三个反应的叙述中,不正确的是( )
| A.①③为置换反应 | B.①②③均为氧化还原反应 |
| C.②为化合反应 | D.三个反应的反应物中硅元素均被氧化 |
将0.03 mol Cl2缓缓通入含0.02mol H2SO3和0.02 mol HBr的混合溶液中,在此过程溶液的c(H+)与Cl2用量的关系示意图是(溶液的体积视为不变)( )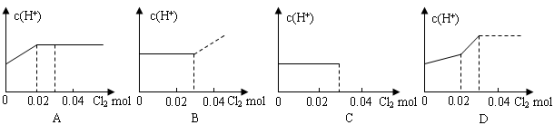
试题篮
()