物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度等有关。下列各组物质:①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与FeCl3溶液。由于浓度不同而能发生不同氧化还原反应的是( )
| A.①③ | B.③④ |
| C.①② | D.①③④ |
在常温下,发生下列几种反应 2KMnO4+ 16HCl = 2KCl + 2MnCl2+ 5Cl2↑ +8H2O
Cl2 + 2NaBr = 2NaCl + Br2 Br2+ 2FeBr2 = 2FeBr3
根据上述反应,下列结论正确的是
| A.还原性强弱顺序为:Br—>Fe2+>Cl— |
| B.氧化性强弱顺序为:MnO4—>Cl2>Br2>Fe3+ |
| C.反应中,当生成1molCl2时,被氧化的HCl为3.2mol |
| D.溶液中可发生反应:2Fe3+ + 2Cl—= 2Fe2+ + Cl2↑ |
F2是氧化性最强的非金属单质,在加热条件下,物质的量相等的F2和烧碱完全反应,生成NaF、H2O和另一种气体,该气体是下列中的()
| A.H2 | B.HF | C.O2 | D.OF2 |
常温下,在溶液中可发生以下反应:
①2Fe2++ Br2= 2Fe3+ + 2Br-,
②2Br-+ Cl2=Br2 + 2Cl-,
③2Fe3+ + 2I-= 2Fe2++ I2;由此判断下列说法错误的是
| A.铁元素在反应①中被还原,在③中被氧化 |
| B.反应②中当有1 mol Cl2被还原时,有2 mol Br-被氧化 |
| C.氧化性强弱顺序为:Cl2 > I2 > Br2 > Fe3+ |
| D.还原性强弱顺序为:I-> Fe2+ > Br-> Cl- |
已知常温下,在溶液中发生如下反应:
①16H++10Z-+2XO4- =2X2++5Z2+8H2O ②2A2++B2=2A3++2B-
③2B-+Z2=B2+2Z- ,由此推断,下列说法中错误的是( )
| A.反应Z2+2A2+=2A3++2Z-可进行 |
| B.反应③是置换反应 |
| C.氧化性由强到弱的顺序是XO4—、Z2、B2、A3+ |
| D.还原性由强到弱顺序是Z-、B-、A2+、X2+ |
下列说法正确的是
| A.绿色食品是不含任何化学物质的食品 |
| B.Na2O2与CO2反应,Na2O2是氧化剂、CO2是还原剂 |
| C.向新制的FeSO4溶液中滴入适量的NaOH溶液,放置片刻,整个反应过程的颜色变化是:浅绿色溶液→白色沉淀→灰绿色沉淀→红褐色沉淀 |
| D.称取等质量的两份铝粉,分别加入过量的稀盐酸和过量的NaOH溶液.则放出氢气的体积(同温同压下)不相等 |
对反应14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4的下列说法正确的是( )
| A.该反应的氧化剂只有CuSO4 |
| B.SO42﹣既不是氧化产物也不是还原产物 |
C.1molCuSO4氧化了 mol的S mol的S |
| D.被还原的S和被氧化的S的质量比为3:7 |
下列比较中,正确的是
| A.原子半径:Na>Mg | B.碱性:NaOH>KOH |
| C.结合H+的能力:CO32¯<Cl¯ | D.还原性:I¯<Br¯ |
已知在酸性溶液中的还原性强弱顺序为:SO2 > I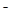 > H2O2 > Fe
> H2O2 > Fe > Cl
> Cl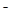 ,下列反应不可能发生的是
,下列反应不可能发生的是
A.2I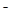 + Fe + Fe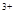 =I2 + Fe =I2 + Fe |
B.2Fe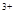 + SO2 + 2H2O=2Fe + SO2 + 2H2O=2Fe + SO + SO + 4H+ + 4H+ |
| C.SO2 + 2H2O + I2=H2SO4 + 2HI |
| D.H2O2 + H2SO4=SO2↑ + O2↑ + 2H2O |
实验室常用NaNO2和NH4Cl反应制取N2。下列有关说法正确的是( )
| A.NaNO2是还原剂 |
| B.NH4Cl中N元素被还原 |
| C.生成1 mol N2时转移6 mol 电子 |
| D.氧化剂和还原剂的物质的量之比是1︰1 |
试题篮
()