A、B、C、D、E、F六种元素位于短周期,原子序数依次增大,C基态原子核外有三个未成对电子,B与D形成的化合物BD与C的单质C2电子总数相等,CA3分子结构为三角锥形,D与E可形成E2D与E2D2两种离子化合物,D与F是同族元素。
根据以上信息,回答下列有关问题:
(1)写出基态时D的电子排布图 。
(2)写出化合物E2F2的电子式 ,化合物ABC的结构式 。
(3)根据题目要求完成以下填空:
BF32-中心原子杂化方式 ;D3中心原子杂化方式 ;
FD42-微粒中的键角 ;FD3分子的立体构型 。
(4)根据等电子原理,指出与BD2互为等电子体且含有C原子的微粒有 、 (要求写一种分子和一种离子)。
W、X、Y、Z四种元素的原子序数依次增大。其中Y原子的L电子层中,成对电子与未成对电子占据的轨道数相等,且无空轨道;X原子的L电子层中未成对电子数与Y相同,但还有空轨道;W、Z的原子序数相差10,且Z原子的第一电离能在同周期中最低。
(1)写出下列元素的元素符号:W ,X ,Y ,Z 。
(2)XW4分子中,中心原子属于 杂化,分子的空间构型为 ;
根据电子云重叠方式的不同,分子里共价键的主要类型为 。
(3)写出Y原子价层电子的排布图
(4)X的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为 。
【化学—选修3物质结构与性质】
已知A、B、C、D四种短周期元素,它们的核电荷数依次增大。A与C原子的基态电子排布中L能层都有两个未成对电子,C、D同主族。 E、F都是第四周期元素,
E原子的基态电子排布中有4个未成对电子,F原子除最外能层只有
1个电子外,其余各能层均为全充满。根据以上信息填空:
(1)基态D原子中,电子占据的最高能层符号 ,该能层具有的原子轨道数为 。
(2)E2+离子的价层电子排布图是 ,F原子的电子排布式是 。
(3)A元素的最高价氧化物对应的水化物中心原子采取的轨道杂化方式为 ,B元素的气态氢化物的VSEPR模型为 。
(4)化合物AC2、B2C和阴离子DAB-互为等电子体,它们结构相似,DAB-的电子式为 。
(5)配合物甲的焰色反应呈紫色,其内界由中心离子E3+与配位体AB-构成,配位数为6,甲的水溶液可以用于实验室中E2+离子的定性检验,检验E2+离子的离子方程为 。
(6)某种化合物由D,E,F三种元素组成,其晶胞如图所示,则其化学式为 ,该晶胞上下底面为正方形,侧面与底面垂直,根据图中所示的数据列式计算该晶体的密度d= g/cm3。(保留两位小数)
【化学-选修3:物质结构与性质】
(1)I.短周期某主族元素M的电离能情况如图(A)所示,则M元素位于周期表的第____族;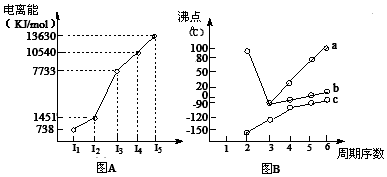
II.图B折线c可以表达出第_________族元素氢化物的沸点的变化规律。两位同学对某主族元素氢化物的沸点的变化趋势画出了两条折线a和b,你认为正确的是:__________(填“a”或“b”);
III.部分有机物的熔沸点见下表: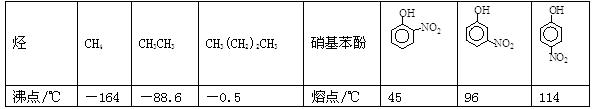
根据物质结构理论,由这些数据你能得出的相关结论是(至少写2条):____________________;
(2)COCl2俗称光气,分子中C原子采取________杂化成键;其中碳氧原子之间共价键含有______(填字母):
a.2个σ键
b.2个π键
c.1个σ键.1个π键;
(3)金属是钛(22Ti) 将是继铜.铁.铝之后人类广泛使用的第四种金属,试回答:
I.Ti元素的基态原子的价电子层排布式为________________________________;
II.已知Ti3+可形成配位数为6的配合物。现有紫色和绿色两种含钛晶体,其组成均为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种晶体的样品配成溶液;
b.向两种溶液中分别滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量发现产生的沉淀质量关系为:绿色晶体为紫色晶体的2/3,
则绿色晶体配合物的化学式为_________________________。
(11分)元素X、Y、Z、Q、W原子序数依次增大,其中X、Y、Z、Q为短周期元素。Z元素的焰色反应为黄色;X与Y形成的气体能使酚酞溶液变红,X与Q形成18电子的分子,其空间构型为v形,W的基态原子3d轨道有8种运动状态不同的电子。请回答下列问题:
(1)Z在周期表中的位置 ;W基态原于的价电子排布图 。
(2)X、Y、Z、Q中,基态原子第一电离能最大的是 (填元素符号)。
(3)在XQ—中Q的杂化类型为 X的氧化物(X2O)晶体结构示意图如下,则1molX2O晶体含有 mol氢键。
(4)ZY3有较强的还原性,遇到NaClO溶液时有无污染的气体生成,其化学方程式为
A、B、C、D、E、X六种元素的原子序数依次递增,A、B、C的基态原子中L层未成对电子数分别为3、2、1,D是短周期中原子半径最大的主族元素,E是主族元素且与X同周期,E与C可形成离子化合物,其晶胞结构如图所示。X位于元素周期表中第四周期ⅠB族。请回答下列问题:
(1)D单质晶体中原子的堆积方式为体心立方堆积,其配位数是 。DAB3中阴离子的立体构型是 。中学化学常见微粒中,与晶体D3AB4中阴离子互为等电子体的分子有 (任写一种)。
(2)X2+离子的电子排布式为______,X2+离子与水分子形成的配离子[X(H2O)4]2+为平面正方形结构,其中的两个H2O被Cl-取代有两种不同的结构,试画出[X(H2O)2(Cl)2]具有极性的分子的结构__________。
(3)A元素分别能与硼、铝形成相同类型的晶体,但是A与硼形成晶体的熔点更高,其原因是 。
(4)AC3的沸点比氨的沸点低得多,原因是 。
(5)若E与C形成的晶体的密度为a g·cm-3,则晶胞的体积是_____ cm3 (用NA表示阿伏伽德罗常数的值,写出表达式即可)。
(本题共12分)元素周期表中ⅦA族元素的单质及其化合物的用途广泛。
23.与氯元素同族的短周期元素的原子,其核外能量最高的电子所处的电子亚层是 ;
24.碘元素在元素周期表中的位置是 ;为防缺碘,食盐中常添加碘酸钾,该物质内存在 键(填化学键类型)。
25.溴单质是唯一常温下呈液态的非金属单质,它的电子式是 ;液溴的保存通常采取的方法是 。
26.通过比较___________或________________可以判断氯、溴两种元素非金属性强弱。
27.工业上,通过如下转化可制得KClO3晶体:
①配平I中反应的总化学方程式,并标出电子转移的方向和数目:
□NaCl + □H2O  □NaClO3+ □
□NaClO3+ □
②II反应过程能析出KClO3晶体而无其它晶体析出的原因是 。
28.CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25℃、101kPa下,已知该反应消耗1 mol CuCl(s),放热44.4 kJ,该反应的热化学方程式是_________________________。
(共14分)W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示。

已知W的一种原子的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z是同周期中非金属性最强的元素。
(1)Y位于元素周期表的位置 ,X与W元素形成的X2W2型化合物的电子式为
(2)Z的气态氢化物和溴化氢相比,较稳定的是 (写化学式)。
(3)Y与Z形成的化合物硬度小、熔点低、沸点低,其晶体中存在的作用力有
其分子属于 (填极性分子或非极性分子),它和足量水反应,有白色胶状沉淀产生,该反应的化学方程式是
(4)在25ºC、101 kPa下,已知Y的气态氢化物在氧气中完全燃烧后恢复至原状态,平均每转移1mol 电子,放热190.0kJ,该反应的热化学方程式是
(10分,每空1分).原子序数小于20的A.B.C.D.E.F.G七种元素,它们的原子序数依次增大,已知C元素是地壳中含量最多的元素;A和D的价电子数相同,C和E的价电子数也相同,且A和D两元素原子核外电子数之和是C.E两元素原子核内质子数之和的1/2;D.E.F三种元素的基态原子具有相同的电子层数,且F原子的p轨道上电子数比E原子的p轨道上多一个电子;B元素原子中未成对电子数与C相同;7种元素的基态原子中,G原子的电子层数最多且和A外于同一主族。
(1)用电子式表示D和E形成化合物的过程________________。
(2)写出基态G原子的简化核外电子排布式___________________________。
(3)A2C2分子中_____ (填“含”或“不含”,下同)σ键, π键,其电子式为:____________。
(4)在A―E.A―F两种共价键中,键的极性较强的是 ,键长较长的是 。
(5)7种元素中的一种或两种元素组成的分子,属于16电子的等电子体的有___________;(填两种,下同)属于18电子的等电子体的有___________;BC分子中,σ键和π键数目之比是________。
(8分,每空1分))有A、B、C、D、E五种短周期元素,其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数;B原子最外层中有两个不成对的电子;D、E原子核内各自的质子数与中子数相等;B元素可分别与A、C、D、E生成RB2型化合物,并知在DB2和EB2中,D与B的质量比为7∶8,E与B的质量比为1∶1。试回答:
(1)写出D元素基态原子的电子排布式:____________________________________。
(2)写出AB2的路易斯结构式:__________________。
(3)B、C两元素的第一电离能大小关系为________>________(填元素符号),
原因是_________________________________________________________________
根据VSEPR模型预测C的氢化物的立体结构为________,中心原子C的轨道杂化类型为________。
C的单质分子中π键的数目为________,B.D两元素的气态氢化物的稳定性大小关为________>________(填化学式)。
短周期元素A、B、C、D原子序数依次增大,且C元素最高价氧化物对应的水化物能电离出电子数相等的阴、阳离子。A、C位于同一主族,A为非金属元素,B的最外层电子数是次外层电子数的3倍,B、C的最外层电子数之和与D的最外层电子数相等。E单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏。请回答下列问题:
(1)C的最高价氧化物对应水化物中含有的化学键类型为 。
(2)写出由AB两种元素组成1:1化合物的电子式
(3)由上述A、B、C、D四种元素中的三种组成某种盐,水溶液显碱性,是家用消毒剂的主要成分。将该盐溶液滴入KI淀粉溶液中,溶液变为蓝色,则反应的离子方程式为 ________________________________ 。
(4)E元素与D元素可形成ED2和ED3两种化合物,下列说法正确的是 (填序号)。
①保存ED2溶液时,需向溶液中加入少量E单质和AD溶液
②ED2只能通过置换反应生成,ED3只能通过化合反应生成
③铜片、碳棒和ED3溶液组成原电池,电子由铜片沿导线流向碳棒
④向淀粉碘化钾溶液和苯酚溶液中分别滴加几滴ED3的浓溶液,原无色溶液都变成紫色
A、B、C均为短周期元素,可形成A2C和BC2两种化合物。A、B、C的原子序数依次递增,A原子的K层的电子数目只有一个,B位于A的下一周期,它的最外能层电子数比K层多2个,而C原子核外的最外能层电子数比次外层电子数少2个。
(1)它们的元素符号分别为:A ;B ;C ;
(2)BC2是由 键组成的 (填“极性”或“非极性”)分子。
(3)画出C原子的核外电子排布图 。
(4)A2C和BC2的空间构形分别是 和 。
下表是元素周期表的一部分,表中所列字母分别代表一种化学元素。请用元素符号等化学用语回答下列有关问题:
(1)上述元素中第一电离能最大的元素是 ,C、D、E、F四种元素第一电离能由大到小的顺序 。
(2)由A、C、D形成的ACD分子中,σ键个数∶π键个数=________。
(3)要证明太阳上是否含有R 元素,可采用的方法是 。
(4)能够说明K、F两元素非金属性强弱的事实是 ;若欲用一个简单实验证明H、I两种元素金属性的强弱,其实验方法是 。
(5)元素M的化合物(MO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。已知MO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断MO2Cl2是_____(填“极性”或“非极性”)分子。
(6)C、D两种元素,C的气态氢化物难溶于水,而D的气态氢化物却极易溶于水,
其原因是 。
(7)在元素N的低价硫酸盐溶液中,加入少量由元素G、L、E组成的化合物(原子个数比为1:1:1),观察到的现象是 ;有关反应的离子方程式为 。
(每空1分,共8分)下列微粒:① ;②
;② ;③
;③ ;④
;④ ;⑤
;⑤ 填写下列空白(填序号)
填写下列空白(填序号)
(1)呈正四面体的是 。
(2)中心原子轨道采取 杂化的化合物是 ,采取
杂化的化合物是 ,采取 杂化的化合物是 ,采取
杂化的化合物是 ,采取 杂化的化合物是 。
杂化的化合物是 。
(3)所有原子共平面的是 ,共线的是 。
(4)微粒存在的配位键的是 。
(5)含有极性键的极性分子是 。
某些元素的性质或原子结构信息如下表所示(每空2分,共16分).:
| A(短周期) |
B(短周期) |
C |
D(短周期) |
| 原子最外层上p电子数等于次外层电子数 |
原子最外层有两个未成对电子,其单质为人类生存必需物质 |
单质为生活中常见的金属材料,有紫红色金属光泽 |
单质是常见的半导体材料,广泛应用于IT行业 |
(1)写出A单质与浓硝酸加热反应的化学方程式: 。
(2)写出B元素在周期表中的位置: ,
写出C元素基态原子的电子排布式: _。
(3)写出A与D的氧化物在高温下反应的化学方程式: _。
(4)写出B、D形成的化合物与NaOH溶液反应的离子方程式: 。
(5)比较A、B、D三种元素原子的第一电离能的大小 (由大到小用元素符号表示)。
(6)等电子原理——原子总数相同、价电子总数相同的粒子具有相似的化学键特征,它们的许多性质是相近的。写出二种由多个原子组成的含有与N3-电子数相同的粒子 (分子离子各一种)的化学式 、 。这些粒子空间构型为 。
试题篮
()