根据要求回答下列问题:
①CaBr2 ②H2O ③NH4Cl ④H2O2 ⑤Na2O2 ⑥Ca(OH)2 ⑦HClO ⑧Al
(1)只含有离子键的是(用序号回答,下同)
(2)含有共价键的离子化合物是
(3)属于共价化合物的是
(4)熔融状态能导电的化合物是
(5)熔融状态时和固态时,都能导电的是
(本小题14分)现有A、B、C、D四种短周期主族元素,其原子序数依次增大。已知A、C位于同一主族,A在周期表中原子半径最小。B、D的最外层电子数相等,且B、D的原子序数之和为A、C原子序数之和的两倍。请回答下列问题:
(1)元素D在周期表中的位置是________________________。
(2)C2B2所含的化学键类型有___________;请写出C2B2与A2B反应的离子方程式________________。
(3)元素B、C形成的简单离子中半径较大的是_________(写电子式)。
(4)仅由C、D两种元素组成的一种盐溶于水后pH>7的原因是_____________ (用离子方程式表示)。
(5)如图所示以铂作电极,以C、D两元素的最高价氧化物的水化物X、Y的溶液作为电解质溶液,A、B元素的单质分别在两电极上发生原电池反应,则通入B单质的电极反应式为_________,通入A单质的X溶液的pH将__________(填“增大”、“不变”或“减小”)。
(14分)A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素。在一定条件下相互转化关系如图所示(部分产物已略去)。
请按要求回答下列问题:
(1)若B、D为短周期同一主族的非金属单质,则反应(III)中氧化产物与还原产物的物质的量之比为___。
(2)若A、B、C均为短周期元素组成的化合物,且溶液都显碱性,D为植物光合作用必须吸收的气体,物质A中化学键的类型为______________________,相同温度下的溶解度B____________C(填“大于、小于、等于”)。
(3)若D为某金属单质,向C的溶液中滴加硝酸银溶液,产生不溶于稀硝酸的白色沉淀,则检验B溶液中阳离子的试剂为_________;C的溶液保存时,常加入D的目的是__________________。
(4)若D为强电解质溶液,A和C在溶液中反应生成白色沉淀B,写出反应(III)的离子方程式是_______________________________;符合条件的D物质可能是_______________(填序号)。
①硫酸 ②碳酸 ③氢氧化钠 ④一水合氨 ⑤氯化钡
(6分)开发新型储氢材料是氢能利用的重要研究方向。
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Ti3+的未成对电子数有______个。
②LiBH4由Li+和BH4-构成,BH4-呈正四面体构型。LiBH4中不存在的作用力有______(填标号)。
A.离子键 B.共价键 C.金属键 D.配位键
③Li、B、H元素的电负性由大到小排列顺序为______。
(2) 金属氢化物是具有良好发展前景的储氢材料。
①LiH中,离子半径:Li+______H-(填“>”、“=”或“<”)。
②某储氢材料是短周期金属元素M的氢化物。M的部分电离能如下表所示:
M是______(填元素符号)。
(3)某种新型储氧材料的理论结构模型如下图所示,图中虚线框内碳原子的杂化轨道类型有______种。
(12分)根据已学知识,回答下列问题:
(1)具有(n-1)d10n s2电子构型的元素位于周期表中区和族。
(2)写出3P轨道上有2个未成对电子的元素名称:。
(3)日常生活中广泛应用的不锈钢,在其生产过程中添加了某种元素X,该元素的价电子排布式为3d54s1,该元素可与氧元素形成离子X2O72-,K2X2O7氧化浓盐酸生成氯气的同时还生成了X3+,写出该反应的离子方程式 。
(4)键能是指气态基态原子形成1 mol化学键释放的最低能量。某些化学键的键能如下表
格所示(单位:kJ·mol-1):
| 键 |
H—H |
N N N |
O=O |
F—F |
H—Cl |
| 键能 |
436 |
946 |
498 |
157 |
431 |
| 键 |
N—N |
P—P |
P—O |
Cl—Cl |
Br—Br |
| 键能 |
193 |
198 |
360 |
242.7 |
193 |
①由表中所列化学键形成的单质分子中,最不稳定的是。
②通过表中键能数据,计算说明N2分子中的键比键稳定(填“ ”或“
”或“ ”)。
”)。
③化学反应的实质是旧化学键断裂和新化学键形成的过程。现有化学反应方程式 ,通过计算可以确定,1molP4(s)参加该反应, (填“吸收”或“放出”)的热量为kJ。
,通过计算可以确定,1molP4(s)参加该反应, (填“吸收”或“放出”)的热量为kJ。
氢气、纳米技术制成的金属燃料、非金属固体燃料已应用到社会生活和高科技领域。(1)已知短周期金属元素A和B,其单质单位质量的燃烧热大,可用作燃料。其原子的第一至第四电离能 如下表所示:
| 电离能(kJ/mol) |
I1 |
I2 |
I3 |
I4 |
| A |
899.5 |
1757.1 |
14848.7 |
21006.6 |
| B |
738 |
1451 |
7733 |
10540 |
①根据上述数据分析, B在周期表中位于 区,其最高价应为 ;
②若某同学将B原子的基态外围电子排布式写成了ns1np1,违反了 原理;
③B元素的第一电离能大于Al,原因是 ;
( 2 )氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
①已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确并阐述理由
。
②C60分子中每个碳原子只跟相邻的3个碳原子形成共价键,且每个碳原子最外层都满足8电子相对稳定结构,则C60分子中σ键与π键的数目之比为 。
A,B,C,D,E,F,G是元素周期表前四周期元素,原子序数依次增大,根据下表提供的有关信息,回答下列问题
| 元素 |
相关信息 |
| A |
所有单质中密度最小 |
| B |
形成化合物种类最多的元素 |
| D |
基态原子中只有3个能级,有2个未成对电子 |
| E |
短周期中原子半径最大 |
| F |
第三周期中电负性最大的元素 |
| G |
最外层只有一个电子,内层填满电子 |
(1)F元素原子的价电子排布式 ,B,C,D三元素第一电离能由大到小顺序为 (填元素符号)
(2)写出由A,B,C,D四种元素形成的一种简单的既能与酸反应又能与碱反应的化合物
(3)写出由元素E、F形成化合物的水溶液用惰性电极电解的离子方程式
(4)由A,B,C形成的三原子化合物中含有σ键 个,π键 个
(5)已知下列反应:
①G(s) + 1/2O2 (g) =" GO" (s) ; △H=-157.0 KJ/mol
②B(s) + O2 (g) = AO2(g) ; △H=-393.5 KJ/mol
写出单质B与足量GO 反应的热化学方程式
(12分)氮化钠(Na3N)是科学家制备的一种重要化合物,它与水作用可产生NH3,请回答:
(1)Na3N的电子式__________________,该化合物是由______________键形成。
(2)Na3N与水反应方程式为____________________________________________。
(3)Na3N放入足量盐酸中生成_______种盐,其化学式为__________________。
(4)比较Na3N中两种粒子的半径:r(Na+)___r(N3-)(填“>”“=”或“<” )
X、Y、Z三种短周期元素,两两之间能组成5种化合物A、B、C、D、E;X、Y、Z三种元素可组成化合物F。已知:化合物A、B、C中原子个数比都为1︰1;B为淡黄色固体,C、E常温下均为无色液体;A是化学式为XZ的离子化合物,A与E反应生成F和一种气体;D是化学式为X2Y的离子化合物,D的阴、阳离子具有相同的电子层结构且与E分子所含电子数相等。 请回答下列问题:
(1)X元素的名称是________________。
(2)X、Y、Z的原子半径从大到小的顺序是(用元素符号表示)____________________。
(3)写出F的电子式______________________________。
(4)已知X单质、A、B、D固体,分别与E反应都生成同一种物质,其中X单质、A、B分别与E的反应均是氧化还原反应。请写出X单质、B分别与E反应的化学方程式___________, ;
B中含有的化学键是 ;请举一例说明B的用途_____________。
(5)请写出由化合物C制取Y的单质反应的化学方程式_______________________________。
按要求回答下列问题:
(1)有下列六种物质:①碳60(C60)晶体②硼晶体③Na2O晶体④ CaF2晶体⑤P4O10晶体⑥碳化硅晶体。其中属于离子晶体的是 ,属于分子晶体的是 ,属于原子晶体的是____。
(2)有下列分子:HCN、P4、SO3、PCl3、BF3,其中属于非极性分子的是 。
(3)有下列离子:SO32-、SO42-、CO32-,其中VSEPR模型为正四面体形的是 ,中心原子的杂化轨道类型属于sp2杂化的是 。
(4)CaO晶胞如右图所示,CaO晶体中Ca2+的配位数为______;与每一个钙离子距离最近并且距离相等的钙离子有____个 ;CaO晶体和NaCl晶体的晶格能分别为:CaO:3 401 kJ/mol、NaCl:786 kJ/mol。导致两者晶格能差异的主要原因_______________。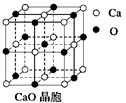
按要求回答下列问题:
(1) 用电子式表示H2O的形成过程________________________。
(2) 用电子式表示MgCl2的形成过程________________________。
现有四种短周期元素X、Y、Z、W,它们的原子序数依次增大。其中:①X原子是元素周期表中原子半径最小的;②Y的L层电子是K层电子的2倍;③Z的最外层电子是内层电子的3倍;④W与X同主族。请回答下列问题:
(1)X的元素符号为 ,Y在周期表中的位置是 ,
Z单质的化学式为 。
(2)X与Z组成的含有非极性共价键的化合物的分子式为 ;化合物W2Z2的电子式为 。
(3)向Na2SiO3的溶液中缓慢通入过量的YZ2,反应的离子方程式是 ;分子中有10个电子,则X与Z组成的分子为 、X与Y组成的分子式为_______。
下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列
问题:
(1)④、⑤、⑥的原子半径由大到小的顺序是____________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是____________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:_____________________________________。
(4)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)_______________________________________。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
A、B、C、D、E五种短周期元素,它们的原子序数依次增大。B原子的最外层电子数是其次外层电子数的2倍;A的一种原子中,质量数与质子数之差为零。D元素的原子最外层电子数为m,次外层电子数为n;E元素的原子L层电子数为m+n,M层电子数为m/2-n。请回答下列问题:
(1)D元素在周期表中的位置是_____________________;
(2)写出一个E和D形成的化合物与水反应的离子方程式_______________________;
(3)已知:甲 + H2O → 丙 + 丁。若甲是由N和Cl元素组成的化合物,其分子结构 模型如下图所示, 丙具有漂白性。则甲中Cl元素的化合价是 ,丁与H2O有相同的电子总数,则丁的化学式为 。
(4)与D同主族上下相邻的元素M、N,原子电子层数M>N>D,三种元素氢化物沸点由大到小的顺序是(填写化学式) 。
(5)写出B与D在高温下完全反应后生成物的电子式___ __ ,结构式___
Ⅰ.下面列出了几组物质或粒子,请将合适的组号填写在空格上。
①金刚石与“足球烯”(C60); ②D与T; ③16O、17O和18O;④氧气(O2)与臭氧(O3);
⑤乙醇(CH3CH2OH)和甲醚(CH3OCH3);
(1)是同素异形体的 , (2)是同位素的 ,(3)是同分异构体的 。
Ⅱ.在下列变化中:①干冰气化 ②硝酸钾熔化 ③食盐溶于水 ④HCl溶于水 ⑤蔗糖溶于水 ⑥HI分解。用序号填空:(1)未破坏化学键的是 ,(2)仅离子键被破坏的是 ,
(3)仅共价键被破坏的是 。
Ⅲ. A~E是几种烃分子的球棍模型,据此回答下列问题:
(1)常温下含碳量最高的气态烃是___________(填字母);
(2)能够发生加成反应的烃有____________(填字母);
(3)一卤代物种类最多的是_____________(填字母);
(4)写出C与溴水反应的化学方程式______________。
试题篮
()