现有①BaCl2 ②金刚石 ③NH4Cl ④Na2SO4 ⑤干冰 ⑥碘 ⑦二氧化硅晶体七种物质,按下列要求回答(将物质的序号填入下列空格中):
(1)属于原子晶体的化合物是_____________。
(2)固态时属于分子晶体的是____________。
(3)熔化时需要破坏共价键的是___________,熔点最低的是___________。
(4)既含有离子键又含有共价键的是__________。
A、B、C、D、E五种短周期元素,其原子序数依次增大,而原子半径按A、C、B、E、D顺序依次增大。A、D同主族;B、D、E三种元素原子的最外层电子数之和为10;E的单质可做半导体材料;C与E两元素形成的化合物可与A、C、D形成的化合物Y发生反应;B元素的气态氢化物与其最高价氧化物的水化物可以发生反应生成化合物M。1molM中含有42mol电子。回答下列问题:
(1)E元素在周期表中的位置 ;化合物M中含有的化学键类型有
(2)比较B、C、E形成的气态氢化物的稳定性由强到弱的顺序是(用化学式表示): ;写出C与A形成的18e-化合物的电子式 ;
(3)用电子式表示A2C的形成过程:
(4)写出题中生成M的化学方程式
下图为周期表中的一部分。已知A、B、C、D均为短周期元素,
A与D原子序数之和为C原子序数的1.5倍。
(1)B元素符号是: _______、D在元素周期表中第_______族。
(2)四种元素中原子半径最大的是(填元素符号)_______,B、C、D三种离子中半径最大的是(填离子符号)_______。
(3)B比C的氢化物的沸点高是因为_____ __;A、D两元素的气态氢化物相互反应的生成物的电子式: ,其中存在_______键、_______(填“极性”或“非极性”)共价键。
(4)写一个离子方程式证明C和D的非金属性相对强弱: 。
(5分)在HF、H2O、NH3、CH4、CO32-、CO2、HI分子中
(1)CO32-的价层电子对的空间构型为
(2)以极性键相结合,具有正四面体结构的非极性分子是 。
(3)以极性键相结合,具有三角锥型结构的极性分子是 。
(4)以极性键相结合,具有V型结构的极性分子是 。
(5)以极性键相结合,而且分子极性最大的是 。
(10分)有A、B、C、D、E五种短周期元素,且相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的氢氧化物是两性氢氧化物,E的阳离子与A的阴离子核外电子层结构相同。请回答下列问题:
(1)B元素在周期表中的位置为 ;
(2)A与氢元素能形成原子物质的量之比为1:1的化合物,其电子式为 ;
(3)向D与E形成的化合物的水溶液中滴入NaOH溶液直至过量,观察到的现象是 ,
最后阶段反应的离子方程式为 ;
(4)B、C、D、E的最高价氧化物的水化物的酸性从强到弱的顺序为(物质用化学式表示)
。
(16分)下图中A~J分别代表相关反应中的一种物质,已知A分解得到等物质的量的B、C、D,已知B、D为常温下气态化合物,C为常温下液态化合物,图中有部分生成物未标出。
请填写以下空白:
(1)A的化学式 ,A物质中的化学键类型 ,B的电子式 。
(2)写出下列反应的化学方程式:
D+G→H ;
F+J→B+C+I ;
(3)0.3mol I与足量C反应转移电子的物质的量为 mol
(4)容积为10mL的试管中充满I和G的混合气体,倒立于盛水的水槽中,水全部充满试管,则原混合气体中I与G的体积分别为 mL, mL。
(12分)(1)一定条件下,一定量的氢气和氧气反应生成1mol水蒸气时放出241.8kJ的热量,写出该反应的热化学方程式: 。
(2)下列物质:①干冰 ②水晶 ③氯化镁 ④氩 ⑤氢氧化钡 ⑥碳酸钠 ⑦CCl4
a.熔化时只克服离子键的是 ,熔化时只克服分子间作用力的是 。
b.只含共价键的是 ,既含共价键又含离子键的是 ;
c.写出⑦的结构式 。
有A、B、C、D、E五种元素,它们均为短周期元素。已知A是非金属性最强的元素,且E与A同族;金属B的原子核内质子数比前一周期的同族元素多8,其单质不能从CuSO4溶液中置换出Cu;C元素有三种同位素,Cl、C2、C3,C1的质量数分别为C2、C3的1/2和1/3;D的气态氢化物溶于水后显碱性。
(1)写出B元素的离子结构示意图 ;C2粒子的符号: ;
(2)B、E两种元素形成化合物的电子式:
(3)A、E两种元素形成的氢化物沸点较高的是: (用化学式表示),其原
因是 。
(4)写出D的气态氢化物与其最高价氧化物的水化物反应的离子方程式
(5)写出D的氢化物(过量)与E的单质发生氧化还原反应生成一种单质和一种盐的化学方程式 。
现有①BaCl2 ②金刚石 ③KOH ④H2SO4 ⑤干冰 ⑥碘片 ⑦晶体硅 ⑧金属铜 八种物质,按下列要求回答:(填序号)
(1)熔化时不需要破坏化学键的是________,熔化时需要破坏共价键的是________,
熔点最高的是________,熔点最低的是________。
(2)属于离子化合物的是________,只有离子键的物质是________,晶体以分子间作用力结合的是________。
(3)请写出③的电子式 ,⑤的电子式 。
A、B、C、D、E均为短周期主族元素,其原子序数依次增大。其中A元素原子核内只有1个质子;A与C,B与D分别同主族; B、D两元素原子序数之和是A、C两元素原子序数之和的2倍。
请回答下列问题:
(1)由上述元素组成的下列物质中属于非电解质的是 (填字母编号)。
a.A2B b.DB2 c.AE d.C2DB3
(2)D元素在元素周期表中的位置为 ;化合物CBA中含有的化学键类型是 ;化合物C2B中两种离子的半径大小关系为 > (填离子符号)。
(3)实验室中欲选用下列装置制取并收集纯净干燥的E2气体。
①实验中应选用的装置为 (按由左到右的连接顺序填写);
②装置A中发生反应的化学方程式为 。
A、B、C、D、E都为短周期元素,A是所有元素中相对原子质量最小的;B的+2价阳离子和C的-1价阴离子都与氖原子具有相同的电子层排布;D在C的下一周期,可与B形成BD2型离子化合物;E和C为同一周期元素,其最高价氧化物的水化物为强酸。
(1)五种元素的元素符号:A 、B 、C 、D 、E 。
(2)B的原子结构示意图为: ;其在周期表中的位置是第 周期,第 主族。
(3)用电子式表示B与C形成化合物的过程:
X、Y、Z、W为按原子序数由小到大排列的四种短周期的元素。其中Y、W位于同一主族,Z、W位于同一周期;Y所组成的单质和氢化物中分别有一种具有漂白性;Z是同一周期中金属性最强的元素,X的某同位素原子的质子数与中子数相等且应用于核聚变反应。请回答下列问题:
(1)W的元素名称是_____。(2)X2Y2的电子式是_______。
(3)Z2WY3与X2WY4反应的离子方程式是____________ _
(4)如图所示的装置,烧杯中盛放的溶液为X2WY4,接通电流表G后,指针发生偏转,此时,负极材料是:__________正极反应式是_____ ___。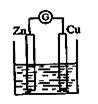
(5)若把铜片放入X2WY4溶液中,溶液无明显的变化,若在X2WY4溶液中加入X2Y2后,观察到铜片附近的溶液变蓝色,请写出反应的化学方程式:____________。
由周期不同的短周期元素X、Y组成的化合物A,是良好的耐热冲击材料。已知A的化学式为XY,且X的阳离子和Y的阴离子具有相同的核外电子排布。
(1)X的单质既可与盐酸反应,又可与NaOH溶液反应,X的原子结构示意图为 。
(2)X的硫酸盐溶液与过量NaOH溶液反应的离子方程式为 。
(3)一定条件下,A和水缓慢作用生成含Y的化合物Z,Z分子含有10个电子。
①Z与H2O2反应,其产物之一是Y的单质,Y 的单质的电子式为 ;
②A的化学式是 。③Z的结构式
(4)X的单质、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到的化合物均由两种元素组成,且都是新型陶瓷材料(在火箭和导弹上有重要应用),其反应的化学方程式是______ 。
A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A与C,B与D分别是同主族元素;已知B、D二元素原子核中质子数之和是A、C二元素原子核中质子数之和的2倍:四种元素形成的单质中有两种是气体,两种是固体。请回答以下问题;
(1)写出由A、B两元素形成的原子个数比为1:1的化合物的化学式 ,此化合物能使酸性KMnO4溶液退色,体现该化合物具有____ 性。
(2)D元素在元素周期表中的位置______,B和C两元素形成的原子个数比为l:l的化合物中含有的化学键的类型为____ 。
(3)A、B、C、D四种原子半径由大到小为 (填元素符号):四种离子半径由大到小为 (填离子符号)。
(4)写出由A、B两元素形成的原子个数比为2:1的化合物与B、C两元素形成的原子个数比为1:1的化合物反应的离子方程式____ 。
(5)用A元素的单质与B元素的单质可制成新型的化学电源,已在宇宙飞船中使用。其构造如下图所示。两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电。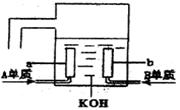
则a是____极, b电极电极反应式为 。
元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4;M原子最外层电子数与次外层电子数之比为3∶4;N-、Z+、X+离子的半径逐渐减小;化合物XN常温下为气体。据此回答:
(1)M、N的最高价氧化物的水化物中酸性较强的是(写出化学式) 。
(2)Z与M可形成常见固体化合物C,用电子式表示C的形成过程 。
(3)已知通常状况下1g X2在Y2中完全燃烧放出a kJ的热量,请写出表示X2燃烧热的热化学方程式 。
(4)X与Y、X与M均可形成18电子分子,这两种分子在水溶液中反应有黄色沉淀生成,写出该反应的化学方程式 。
(5)化合物A、B均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比为1∶1∶1,A溶液中水的电离程度比在纯水中小。则化合物A中的化学键类型为 ;若B为常见家用消毒剂的主要成分,则B的化学式是 。
(6)均由X、Y、Z、M四种元素组成的两种盐发生反应的离子方程式是 ;其中一种是强酸所成的酸式盐,写出Ba(OH)2溶液中逐滴加入该盐溶液至中性的离子方程式 。
试题篮
()