有A、B、C、D、E五种短周期元素,其原子序数依次增大。A原子的电子层数与它的核外电子总数相同,B原子核外最外层电子数是次外层电子数的2倍,C元素的原子基态时2p能级是2s能级上的电子数的2倍,D是该周期中原子半径最大的主族元素,E原子的第一至第四电离能(kJ·mol-1)分别为:578、1817、2745、11575。请回答下列问题:
(1) C、D两元素形成的化合物的晶体类型是 。BC2的结构式
(2)若F是D的同主族下一周期元素,则F的电子排布式是:
(3)写出E的最高价氧化物对应的水化物与D的最高价氧化物对应的水化物反应的离子方程式 。
(4)A2C分子间因存在“氢键”的作用而彼此结合形成(A2C)n。在该分子形成的晶体中每个A2C分子被4个A2C分子包围形成变形的四面体,通过“氢键”相互连接成庞大的分子晶体,其结构示意图如右图所示,试填空。
①含1molA2C的该晶体中有_____mol“氢键”。
②若G是C的同主族下一周期元素,请比较A2C与A2G沸点的高低______________。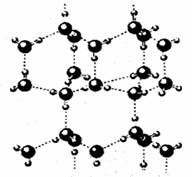
(10分)有A、B、C、D、E、F六种元素,已知:
①它们位于三个不同短周期,核电荷数依次增大 ②B与F同主族。
③B、C分别都能与D按原子个数比1∶1或1∶2形成化合物。
④A、E分别都能与D按原子个数比1∶1或2∶1形成化合物。
⑤E元素的电离能数据如下 (kJ·mol-1):
| I1 |
I2 |
I3 |
I4 |
… |
| 496 |
4562 |
6912 |
9540 |
… |
(1)写出只含有A、B、D、E四种元素的两种无水盐的化学式__________、__________。
(2)B2A2分子中存在______个σ键,______个π键。
(3)人们通常把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以用于计算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。下表列出了上述部分元素形成的化学键的键能:
| 化学键 |
F—D |
F—F |
B—B |
F—B |
C—D |
D—D |
| 键能/kJ·mol-1 |
460 |
176 |
347.7 |
347 |
745 |
497.3 |
试计算1 mol F单质晶体燃烧时的反应热ΔH=_____ (要写单位)。
Q、R、X、Y、Z五种元素的原子序数依次递增。已知:①Z元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,其余的均为短周期主族元素; ②Y原子价电子排布msnmpn ③R原子核外L层电子数为奇数; ④Q、X原子p轨道的电子数分别为2和4。请回答下列问题:
(1)Z的元素符号为_______,在周期表中的____ 分区。
(2)向Z的硫酸盐的溶液中逐滴加入R的氢化物的水溶液至过量,可观察到的现象为___________.此时Z2+与R的氢化物形成了配位数为4的配合物离子,该离子中化学键的类型有 (填序号)。
A 配位键 B 极性共价键 C 非极性共价键 D 离子键
(3)氢化物的沸点:X的比同族其它元素高的原因是 。Q和Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是___ __(填序号)。
a.稳定性:甲>乙,沸点:甲>乙 b.稳定性:甲>乙,沸点:甲<乙
c.稳定性:甲<乙,沸点:甲<乙 d.稳定性:甲<乙,沸点:甲>乙
(4)Q、R、X的第一电离能由小到大的顺序为_______________。R、X、Y四种元素的原子半径由小到大的顺序为_______ _(均用元素符号表示)。
(5)Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为____ _。
A、B、C、D、E、F、G均是原子序数小于36的元素。A的基态原子外围电子排布式为3s2;B原子的L电子层的P能级上有一个空轨道; C元素的基态原子最外层有3个未成对电子,次外层有2个电子; D 的原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反;E是海水中除氢、氧元素外含量最多的元素;F和G在周期表中既处于同一周期又位于同一族,且原子序数F比G小2。
根据信息回答下列问题:
(1)C的外围电子排布图为 。C与氢元素可分别形成含10个电子的分子、阴离子和阳离子,阳离子中中心原子的杂化类型为 ;分子的VSEPR模型名称为 ;阴离子的立体构型为___ __。
(2)G的价电子排布式为 。用电子式表示化合物AE2的形成过程 。
(3)F与BD易形成配合物F(BD)5,在F(BD)5中F的化合价为_______;与BD分子互为等电子体的分子和离子分别为 和 (填化学式)。
(4)E有多种含氧酸根①EO- ②EO2- ③EO3- ④EO4-,其中空间构型为四面体型的是 。(填序号)
(5)B、C、D、E原子相互化合形成的分子有多种,请列举两种分子内所有原子都满足最外层8电子稳定结构的分子:______________________(写分子式)
下表中的数据是破坏1 mol物质中的化学键所消耗的能量(kJ):
| 物质 |
Cl2 |
Br2 |
I2 |
HCl |
HBr |
HI |
H2 |
| 能量(kJ) |
243 |
193 |
151 |
431 |
366 |
298 |
436 |
根据上述数据问题。
(1)下列物质本身具有的能量最低的是 _____(填序号)A.H2 B.Cl2 C.Br2 D.I2
化合物HCl、HBr、HI中______受热时最稳定。
(2)1molH2在2mol Cl2中燃烧,放出热量________ kJ 。一定条件下,1mol H2分别与足量Cl 2、Br2、I2反应,放出热量由多到少的顺序是________ (填序号)A Cl 2<Br2<I2 B Cl 2>Br2>I2
(3)下列有关化学键及键参数的说法中正确的是 (填序号)
① 原子或分子间的相互作用叫化学键
② 氯分子中两个氯原子间的距离是键长
③ 键长的大小与成键原子的半径和成键数目有关
④ 键角是描述分子立体结构的重要参数
(4)下列事实不能用键能的大小来解释的是 (填序号)
A.乙炔比氮气均含三键但是前者比后者容易发生加成反应
B.N2、O2、F2跟氢气的反应能力依次增强
C.硝酸是挥发性酸,而硫酸、磷酸是难不挥发性酸
(5)氰气[(CN)2]无色、剧毒、有苦杏仁味,和卤素单质性质相似。
①写出(CN)2与苛性钠溶液反应的离子方程式______________________;
②已知氰分子中键与键之间的夹角为180.,并有对称性,则结构式为_______
③氰分子中碳原子为_______杂化;一个氰分子中包含_______个σ键,____个π键。
现有①Ar ②金刚石 ③NH4Cl ④SiO2 ⑤干冰 ⑥K2S六种物质,按下列要求回答:(填序号)
(1)只存在共价键的是__ ___,既存在离子键又存在共价键的是 。
(2)熔化时不需要破坏化学键的是_______,熔化时需要破坏共价键的是 。
在下列物质中:①碘②烧碱③NaCl ④干冰⑤氯化氢⑥Na2O2。
用序号填写下列空白:
(1)既含有离子键又含有非极性键的化合物是 ;
(2)仅含有离子键的化合物是 ;
(3)仅含有共价键的单质是 。
在HF、H2O、NH3、CH4、CO2-3、CO2、HI分子中
(1)CO2-3的价层电子对的空间构型为 ,离子的空间构型为 。
(2)以极性键相结合,具有正四面体结构的非极性分子是 。
(3)以极性键相结合,具有三角锥型结构的极性分子是 。
(4)以极性键相结合,具有折线型结构的极性分子是 。
(5)以极性键相结合,而且分子极性最大的是 。
(6)NH3的价层电子对的空间构型为 ,分子的空间构型为
1994年度诺贝尔化学奖授予为研究臭氧做出贡献的化学家。O3能吸收有害紫外线,保护人类赖以生存的空间。O3的分子结构如图,呈V型,两个O----O键的夹角为116.5o。三个原子以一个O原子为中心,另外两个O原子分别构成一个共价键;中间O原子提供2个电子,旁边两个O原子各提供一个电子,构成一个特殊的化学键——三个O原子均等地享有这个电子。请回答:
(1)臭氧与氧气的关系是_____________
(2)写出下列分子与O3分子的结构最相似的是_______________
| A.H2O | B.CO2 | C.SO2 | D.BeCl2 |
(3)分子中某原子有一对或几对没有跟其他原子共用的价电子叫孤对电子,那么O3分子有 对孤对电子。
(4)O3分子是否为极性分子 (填是或否)。
(5)O3具有强氧化性,它能氧化PbS为PbSO4而O2不能,试配平:
PbS + O3 ==== PbSO4 + O2
生成1mol O2的转移电子物质的量为 mol。
有下列分子或离子:(1)BF3 (2)H2O (3) NH4+
(4)SO2 (5)HCHO (6)PCl3 (7)CO2
粒子构型为直线型的为 :粒子的立体构型为V型的为 :粒子的立体构型为平面三角形的为 :粒子的立体构型为三角锥型的为 ::粒子的立体构型为正四面体的为 。
氯化溴(BrCl)的化学性质类似于卤素单质,试回答下列问题:
(1)氯化溴的电子式是 ,它是由 键形成的 分子。
(2)氯化溴和水反应生成了一种三原子分子,该分子的电子式为 。
原子序数依次增大的X、Y、Z、W四种元素,原子序数均小于36。已知X、Y和Z为第三周期元素,其原子的第一至第四电离能如下表:
| 电离能/kJ·mol—1 |
I1 |
I2 |
I3 |
I4 |
| X |
496 |
4562 |
6912 |
9543 |
| Y |
738 |
1451 |
7733 |
10540 |
| Z |
578 |
1817 |
2745 |
11578 |
(1)X、Y、Z的电负性从大到小的顺序为 (用元素符号表示),元素Y的第一电离能大于Z的原因是 。
(2)W元素应用广泛,是一种重要的生物金属元素,如人体内W元素的含量偏低,则会影响O2在体内的正常运输。已知W2+与KCN溶液反应得W(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成配合物,其配离子结构如图所示。
①W元素基态原子价电子排布式为 。
②已知CN—与 分子互为等电子体,1molCN—中 键数目为 。
键数目为 。
③上述沉淀溶解过程的化学方程式为 。
在HF、H2O、NH3、CH4、N2、CO2、HI分子中:
(1)以非极性键结合的非极性分子是 。
(2)以极性键相结合,具有正四面体结构的非极性分子是 。
(3)以极性键相结合,具有三角锥型结构的极性分子是 。
(4)以极性键相结合,具有v型结构的极性分子是 。
(5)以极性键相结合,而且分子极性最大的是 。
下列七种物质中 Ne O2 H2O NH3 H2SO4 KOH MgCl2
只含有共价键的是 ,只含有离子键的是 ,既含有离子键又含有共价键的
是 属于共价化合物的是 ,属于电解质的是 。(填化学式)
试题篮
()