常温下,下列溶液中的微粒浓度关系正确的是
常温下甲、乙两醋酸溶液,测得甲的pH= a,乙的pH= a+1
下列推断中正确的是( )
| A.甲中由水电离产生的H+的物质的量浓度是乙的0.1倍 |
| B.物质的量浓度c(甲)=10c(乙) |
| C.中和等物质的量的NaOH溶液,需甲、乙两酸的体积V(乙)>10V(甲) |
| D.甲中的c(OH-)为乙中的c(OH-)的10倍 |
下列各项中的两个量,其比例2:1的是( )
| A.硫酸铵固体中n(NH4+)与n(SO42—) |
| B.相同温度下,0.01 mol/L的醋酸溶液与0.02 mol/L 醋酸溶液中的c(H+) |
| C.液面均在“0”刻度时,50 mL酸式滴定管和25 mL酸式滴定管内所盛溶液的体积 |
| D.40℃时pH=7的(NH4)2SO4与NH3·H2O的混合液中,c(NH4+)与c(SO42—) |
下列说法正确的是
| A.盐溶液不是促进就是抑制水的电离 | B.弱酸对水的抑制作用就比强酸弱得多 |
| C.催化剂能改变可逆反应达到平衡的时间 | D.硫酸氢钠溶液显酸性,是因为电离大于水解 |
(12分)以硫铁矿为原料生产硫酸所得的酸性废水中砷元素含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,相关数据如下表。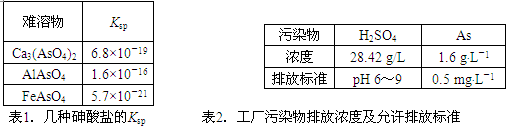
回答以下问题:
⑴该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)= ________mol·L-1。
⑵写出难溶物Ca3(AsO4)2的Ksp表达式:Ksp[Ca3(AsO4)2]= ________,若混合溶液中Al3+、Fe3+的浓度均为1.0×10-4mol·L-1,c(AsO43-)的最大是 ___mol·L-1。
⑶工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),写出该反应的离子方程式 。
⑷在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降。
①pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为 __;
②Ca3(AsO4)2在pH调节到8左右才开始沉淀的原因为 _____。
物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看做是化学平衡的一种。请根据所学化学知识回答下列问题:
Ⅰ、已知0.01mol/L的NaHCO3溶液呈碱性。
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
① ② ③ 。
(2)溶液中共有 种不同的粒子(指分子和离子)。
(3)该溶液中的离子浓度由大到小的顺序是: 。
(4)向该溶液中加入AlCl3溶液,有白色胶状沉淀生成,同时产生一种无色无味并能使澄清石灰水变浑浊的气体,写出该反应的离子方程式: 。
已知在常温下测得浓度均为0.1 mol·L-1的下列三种溶液的pH:
| 溶质 |
NaHCO3 |
Na2CO3 |
NaCN |
| pH |
8.4 |
11.6 |
11.1 |
下列说法中正确的是
A.阳离子的物质的量浓度之和:Na2CO3>NaCN>NaHCO3
B.相同条件下的酸性:H2CO3<HCN
C.三种溶液中均存在电离平衡和水解平衡
D.升高Na2CO3溶液的温度, 减小
减小
常温下,有物质的量浓度均为0.1mol·L—1的CH3COOH溶液和NaOH溶液,下列说法正确的是
| A.CH3COOH溶液的pH=1 |
| B.往醋酸溶液中加水,c(OH—) 和c(H+)均增大 |
| C.两溶液等体积混合, c(Na+)﹥c(CH3COO—) |
| D.两溶液按一定体积比混合,可能存在:c(CH3COO—) ﹥c(Na+) |
下列变化规律不正确的是( )
| A.温度升高,水的电离平衡向右移动 |
| B.加水稀释时,醋酸钠的水解平衡向左移动 |
| C.增大压强,对醋酸的电离平衡影响不大 |
| D.向氯化铁溶液中加入氧化钠,水解平衡向右移动 |
缓冲溶液可以抵抗少量酸或碱对溶液PH的影响。人体血液里最主要的缓冲体系是碳酸氢盐缓冲体系(H2CO3/HCO3-),以维持血液PH的稳定。已知人体正常体温时,H2CO3 HCO3-+H+的Ka=10-6.1,正常血液中c(HCO3-):c(H2CO3)≈20:1,lg2=0.3,lg5=0.7则下列判断正确的是
HCO3-+H+的Ka=10-6.1,正常血液中c(HCO3-):c(H2CO3)≈20:1,lg2=0.3,lg5=0.7则下列判断正确的是
| A.正常人血液内Kw=10-14 |
| B.由题给数据可算得正常人血液的pH约为7.4 |
| C.正常人血液中存在:c(HCO3-)+c(OH-)+2c(CO32-)=c(H+)+c(H2CO3) |
| D.当过量的碱进入血液中时,只发生反应:HCO3-+OH—=CO32-+H2O |
下列说法正确的一组是( )
①不溶于水的盐(CaCO3、BaSO4等)都是弱电解质
②盐都是强电解质
③0.5 mol·L-1的所有一元酸中氢离子浓度都是0.5 mol·L-1
④强酸溶液中氢离子浓度一定大于弱酸溶液中氢离子浓度
⑤电解质溶液导电的原因是溶液中有自由移动的阴、阳离子
⑥熔融的电解质都能导电
| A.①③⑤⑥ | B.②④⑤⑥ | C.只有⑤ | D.只有⑥ |
在T ℃时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g/cm3,溶质的质量分数为w,其中含NH4+的物质的量为b mol。下列叙述中正确的是( )
A.溶质的质量分数为w= ×100% ×100% |
B.溶质的物质的量浓度c= mol/L mol/L |
C.溶液中c(OH-)= mol/L mol/L |
| D.上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于0.5w |
用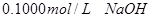 分别滴定
分别滴定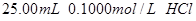 和
和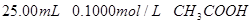 ,滴定过程中
,滴定过程中 变化曲线如下图所示。
变化曲线如下图所示。
请回答:
(1)滴定盐酸的 变化曲线为 (填“图1”或“图2”),判断的理由是
变化曲线为 (填“图1”或“图2”),判断的理由是
。
(2)滴定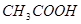 溶液的过程中,
溶液的过程中,
①当滴加 后,溶液中离子浓度由大到小的顺序为 .
后,溶液中离子浓度由大到小的顺序为 .
②当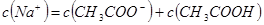 时,溶液
时,溶液 7(填“>”、“=”或“<”)。
7(填“>”、“=”或“<”)。
按要求回答下列问题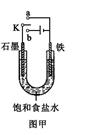
(1)用标准NaOH溶液滴定未知浓度的盐酸,用酚酞作指示剂,下列操作中会导致实验结果偏低的是 (填序号 )
①碱式滴定管用蒸馏水洗净后没有用标准液润洗
②锥形瓶用蒸馏水洗净后没有用待测液润洗
③用酸式滴定管加待测液时,刚用蒸馏水洗净后的滴定管未用待测液润洗
④滴定前滴定管尖端有气泡,滴定后气泡消失
⑤终点读数时俯视,其他读数方法正确
(2)某课外活动小组同学用右图甲装置进行实验,试答下列问题: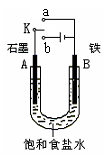
①若开始时开关K与a连接,则铁发生电化学腐蚀中的 腐蚀。
②若开始时开关K与b连接,则总反应的离子方程式为 。
(3)常温下,如果取0.1mol/L HA溶液与0.1mol/L NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,求出混合液中下列算式的精确计算结果(填具体数字):c(OH-)-c(HA)= ___________ mol/L。
(4)在Cl-、Al3+、HSO4-、K+、HS-五种离子中,只能水解不能电离的离子是 ,只能电离不能水解的离子是 ,既能电离又能水解的离子是 ,写出能水解离子的水解离子方程式 , 。
(5)已知25℃时,Mg(OH)2的溶度积常数Ksp = 5.6×10-12,测得某溶液的pH = 13,则此温度下溶液中的c(Mg2+) = ____________________。
下列电离方程式书写正确的是( )
A.(NH4)2SO4 2NH4+ + SO42- 2NH4+ + SO42- |
B.H2CO3 2H+ + CO32- 2H+ + CO32- |
| C.H2SO4 =2H+ + SO42- | D.NaHS=Na+ + H+ + S2- |
试题篮
()