用惰性电极实现电解,下列说法正确的是
| A.电解氢氧化钠稀溶液,溶液浓度增大pH变小 |
| B.电解氯化钠溶液,溶液浓度减小pH不变 |
| C.电解硝酸银溶液,要消耗OH--溶液pH变小 |
| D.电解稀硫酸,实质是电解水,溶液pH不变 |
依据有关化学原理推断正确的是
| A.常温常压下,弱酸A的浓度小于弱酸B,则A的电离程度一定大于B |
| B.晶体A易溶于CCl4,则A一定是分子晶体 |
| C.在溶液中单质A能置换出金属B,则单质A可以是金属也可以是非金属 |
| D.能量越低越稳定,故自然界的物质都以能量最低的形态存在 |
下列电解质溶液的有关叙述正确的是
| A. |
同浓度、同体积的强酸与强碱溶液混合后,溶液的
|
| B. |
在含有
|
| C. |
含l
|
| D. |
在
|
在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)常温下将0.01 mol NH4Cl和0.002 mol NaOH溶于水配成1L溶液。
①溶液中浓度为0.01 mol·L-1的离子是 。
②物质的量之和为0.01 mol的两种粒子是 和 。
(2)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈 (填“碱性”、“酸性”或“中性”),醋酸体积 氢氧化钠溶液体积(填“>”、“<”或“=”)。
(3)将m mol·L-1的醋酸和n mol·L-1的氢氧化钠溶液等体积混合后溶液的pH=7, m与n的大小关系是m n。(填“>”、“<”或“=”)
(4)浓度为0.100 mol·L-1的下列各物质的溶液中,c( )由大到小的顺序是
)由大到小的顺序是
①NH4Cl ②NH4HSO4 ③NH3·H2O ④CH3COONH4
(5)某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A=H++HA- HA- H++A2-
H++A2-
已知0.1 mol·L-1的NaHA溶液pH=2,则0.1 mol·L-1的H2A溶液中氢离子的物质的量浓度
0.11 mol·L-1(填“>”“=”或“<”)。
某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度。
(1)滴定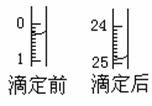
①用______式滴定管盛装0.1000 mol/L盐酸标准液,锥形瓶中装有25.00mL待测烧碱溶液。上图表示某次滴定时50 mL滴定管中前后液面的位置。请将用去的标准盐酸的体积填入②表空格中。
②有关数据记录如下:
| 滴定序号 |
待测液体积(mL) |
所消耗盐酸标准液的体积(mL) |
||
| 滴定前 |
滴定后 |
消耗的体积 |
||
| 1 |
25.00 |
0.50 |
25.95 |
25.45 |
| 2 |
25.00 |
|
|
|
| 3 |
25.00 |
6.00 |
31.55 |
25.55 |
(2)根据所给数据,计算出烧碱样品的物质的量浓度(注意保留合适的有效数字)。
c(NaOH) = _____________ 。
(3)读数时,若滴定前仰视,滴定后俯视,则会使最终测定结果_________。(填“无影响”、“偏高”、“偏低”)
醋酸溶液中存在电离平衡CH3COOH H++CH3COO-,下列叙述不正确的是
H++CH3COO-,下列叙述不正确的是
| A.0.10mol/L醋酸溶液中粒子浓度的关系满足: c(CH3COOH)>c(H+)>c(CH3COO-)>c(OH-) |
| B.0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)减小 |
| C.CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动 |
| D.常温下pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液pH<7 |
在25℃时,将两个铜电极插入到一定的Na2SO4饱和溶液中,通直流电电解并不断搅拌,当阴极上收集到a mol的气体的同时,溶液中析出了b mol的结晶水合物Na2SO4·10H2O,若保持温度不变,则所剩溶液中溶质的质量分数是
| A.71b/18a | B.71b/36a | C.71b/(161b+18a) | D.71b/(161b+9a) |
下列说法错误的是 ( )
| A.食醋用氢氧化钠溶液滴定开始时,溶液的PH通常变化缓慢,当接近完全反应时(即滴定终点),PH出现突变,称为滴定突跃。 |
| B.纸层析法分离铁离子和铜离子实验中,点样后的滤纸晾干后将其末端浸入展开剂中约0.5cm。 |
| C.Cu2+与足量氨水反应的离子方程式 Cu2++2NH3·H2O==Cu(OH)2↓+2NH4+ |
| D.硝酸钾饱和溶液冷却未出现结晶时,可以用玻棒充分磨擦器皿壁促使晶体析出。 |
下列有关溶液中微粒的物质的量浓度关系正确的是
| A.某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH-)+c(HA-)+c(A2-) |
| B.物质的量浓度相等的①NH4HCO3溶液、②NH4Cl溶液、③NH4HSO4溶液中,c(NH4+)的大小关系:①>②>③ |
| C.0.1 mol·L-1 CH3COONa 溶液与0.05 mol·L-1盐酸等体积混合后的酸性溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) |
| D.0.1mol·L-1(NH4)2Fe(SO4)2溶液中: c(NH4+)+ c(NH3·H2O) + c(Fe2+)="0.3" mol·L-1 |
下列物质中属于强电解质的是( )
①NaOH ②NH3·H2O ③CaCO3 ④CH3COOH ⑤NaHCO3 ⑥氢氧化铝
⑦氯化铵 ⑧二氧化碳 ⑨乙醇⑩铜
| A.①③⑤⑦ | B.②④⑥⑦ | C.①③⑥⑦ | D.除⑧⑨⑩ |
现有甲、乙两种溶液:甲 pH=2(c(H+)=10-2 mol/L)的醋酸溶液
乙 pH=2(c(H+)=10-2 mol/L)的盐酸
请根据下列操作回答问题:
(1)取10mL的甲溶液,加入等体积的水,醋酸的电离平衡 移动(填“向左”、“向右”或
“不”);另取10mL的甲溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),
待固体溶解后,溶液中c(H+)/c(CH3COOH)的比值将 (填“增大”、“减小”或“无法确定”)。
(2)相同条件下,取等体积的甲、乙两溶液,各稀释100倍。稀释后的溶液,其溶液中大小关系为:c(H+) (甲) c(H+) (乙)(填“大于”、“小于”或“等于”)。
(3)各取25mL的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:V(甲) V(乙)(填“大于”、“小于”或“等于”)。
(4)下列事实能证明乙酸(CH3COOH)是弱电解质的是( )
| A.用乙酸(CH3COOH)溶液做导电性试验灯光较暗 | B.乙酸(CH3COOH)是共价化合物 |
| C.常温下,0.1 mol/L乙酸(CH3COOH)溶液的pH为2.2 | D.乙酸(CH3COOH)溶液不与NaCl反应 |
下列装置图或曲线图与对应的叙述相符的是( ) 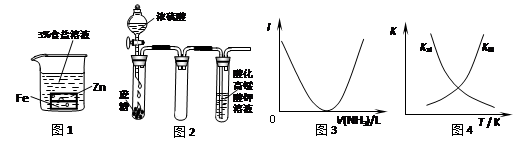
| A.图1:负极反应是Fe-2e-=Fe2+ |
| B.图2:酸性KMnO4溶液中没有气泡出现,但溶液颜色会逐渐变浅乃至褪去 |
| C.图3:可表示乙酸溶液中通入氨气至过量过程中溶液导电性(I )的变化 |
D.图4:可表示在恒容密闭容器中反应“2SO2(g) +O2(g) 2SO3(g) ΔH<0”的平衡常数K正、K逆随温度的变化 2SO3(g) ΔH<0”的平衡常数K正、K逆随温度的变化 |
常温下,下列溶液的pH或微粒的物质的量浓度关系正确的是( )
A.某溶液中由水电离出的c(OH-) = 1×10-amol·L-1,若a>7时,则该溶液的pH一定为14-a
B.等体积、等物质的量浓度的Na2SO3溶液与NaHSO3溶液混合:
c(Na+) = c(SO32-) + c(HSO3-) + c(H2SO3)
C.将0.2mol·L-1的某一元酸HA溶液和0.1mol·L-1的NaOH溶液等体积混合后溶液的pH大于7,则反应后的混合液:2c(OH-)+c(A-)=2c(H+)+c(HA)
D.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:c(Na+)>2c(R2-)+c(HR-)
用0.01 mol/L H2SO4滴定0.01mol/L NaOH溶液,中和后加水至100ml,若滴定时终点判断有误差:①多加1滴H2SO4;②少加1滴H2SO4;(设1滴为0.05ml)则①和②c(H+)的比值是( )
| A.10 | B.50 | C.5×103 | D.104 |
试题篮
()