将0.1mol/L的醋酸钠溶液20mL与0.1mol/L盐酸10mL混合后,溶液显酸性,则溶液有关微粒的浓度关系正确的是
A c (Ac-)>c (Cl-)>c (H+)>c (HAc)
B c (Ac-)>c (Cl-)>c (HAc)>c(H+)
C c (Ac-)=c (Cl+)>c (H+)>c (HAc)
D c (Na+)+c (H+)=c (Ac-)+c (OH-)
常温下,下列溶液中c(H+)最小的是
| A.c(OH-)=1×10-11mol·L-1 | B.pH=3的CH3COOH溶液 |
| C.pH=4的H2SO4溶液 | D.c(H+)=1×10-3mol·L-1 |
向三份0.1 mol/L CH3COONa溶液中分别加入少量NH4NO3、Na2SO3、FeCl3固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为
| A.减小、增大、减小 | B.增大、减小、减小 |
| C.减小、增大、增大 | D.增大、减小、增大 |
下列电离方程式中,正确的是
| A.Ba(OH)2 =Ba2++ (OH)- | B.FeCl3=Fe2++3Cl- |
| C.H2SO4 =H2++SO42- | D.Al2(SO4)3=2Al3++3SO42- |
下列化学原理表述正确的是 ( )
| A.氢硫酸溶液加水稀释,电离程度增大,H+浓度增大 |
| B.同体积同pH的盐酸和醋酸与足量的锌反应,醋酸的反应速率快,生成H2的物质的量多 |
C.NaHCO3溶液不显中性的原因:HCO3-+H2O CO32-+H3O+ CO32-+H3O+ |
| D.Na2CO3溶液中满足:2c(Na+)=c(CO32-)+ c(HCO3-)+ c(H2CO3) |
向15mL 0.1mol·L-1KOH溶液中逐滴加入0.2 mol·L-1甲酸(HCOOH,一元弱酸)溶液,溶液pH和加入的甲酸的体积关系曲线如右图所示,有关粒子浓度大小关系正确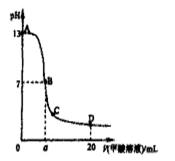
A.在A、B间任意一点c(K+) > c(HCOO-) > c(OH-) > c(H+)
B.在B点:c(K+) = c(HCOO-) > c(OH-) = c(H+),且a=7.5
C.在C点:c(HCOO-) > c(K+) > c(OH-) > c(H+)
D.在D点:c(HCOO-) + c(HCOOH) > 2c(K+)
在CH3COOH H++CH3COO-的电离平衡中,要使电离平衡右移且氢离子浓度增大,应采取的措施是
H++CH3COO-的电离平衡中,要使电离平衡右移且氢离子浓度增大,应采取的措施是
| A.加入NaOH | B.加入盐酸 |
| C.加水 | D.升高温度 |
向ZnSO4溶液中加入Na2S溶液时,得到白色沉淀,然后向白色沉淀中滴加CuSO4溶液,发现沉淀变为黑色,则下列说法不正确的是( )
| A.白色沉淀为ZnS,黑色沉淀为CuS | B.上述现象说明ZnS的Ksp小于CuS的Ksp |
| C.利用该原理可实现一种沉淀转化为更难溶的沉淀 | D.该过程破坏了ZnS的溶解平衡 |
25℃时,0.01 mol/L的HCl溶液中,由水电离出的H+浓度是( )
| A.1×10-7mol·L-1 | B.1×10-12mol·L-1 |
| C.1×10-2mol·L-1 | D.1×10-14m ol·L-1 ol·L-1 |
在盛有1mL1mol·L-1AlCl3溶液的试管中加入2 mL10%的NH4F溶液,再加入1mL3mol·L-1氨水,没有生成白色沉淀,其原因是( )
| A.溶液的碱性不够强 | B.Al3+不与氨水反应 |
| C.生成的Al(OH)3溶解了 | D.Al3+几乎都与F-结合生成了新的物质 |
请回答下列问题:
(1)①现有0.1mol/L的纯碱溶液,若用pH试纸测定溶液的pH,其正确的操作是 。
②纯碱溶液呈碱性的原因是(用离子方程式表示) 。
(2)①已知4.4g丙烷完全燃烧生成二氧化碳气体和液态水,并放出222.0kJ的热量,请写出反应的热化学方程式: 。
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJ/mol,实验测得甲烷与丙烷的混合气体1mol完全燃烧生成液态水和二氧化碳气体时,放热1776.7kJ,则混合气体中甲烷与丙烷的体积比为 。
pH=11的x、y两种碱溶液各5mL,分别稀释至500mL,其pH
与溶液体积(V)的关系如图所示,下列结论正确的是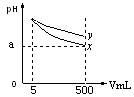
| A.相同温度下,x的的电离平衡常数小于y |
| B.若x、y是一元碱,等物质的量浓度的盐酸盐溶液,y的pH大 |
| C.若x、y都是弱碱,则a的值一定大于9 |
| D.完全中和x,y两溶液时,消耗同浓度稀硫酸的体积V(x)>V(y) |
下列说法错误的是
| A.将pH=4的醋酸稀释后,溶液中所有离子的浓度均减小 |
| B.pH=11的某溶液中,水的电离可能促进也可能是抑制 |
| C.改变条件使醋酸的电离平衡向右移动,醋酸的电离度可能增大也可能减小 |
| D.改变条件使醋酸钠溶液中的醋酸根离子浓度增大,溶液的pH可能减小也可能增大 |
某学生用 和
和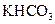 组成的混合物与盐酸反应并进行实验,测得如下数据(盐酸的物质的量浓度相等)
组成的混合物与盐酸反应并进行实验,测得如下数据(盐酸的物质的量浓度相等)
| |
50mL盐酸 |
50mL盐酸 |
50mL盐酸 |
| m(混合物) |
9.2g |
15.7g |
27.6g |
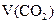 (标准状况) (标准状况) |
2.24L |
3.36L |
3.36L |
则下列分析推理中不正确的是( )
A.盐酸的物质的量浓度为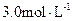 |
B.根据表中数据能计算出混合物中 的质量分数 的质量分数 |
| C.加入混合物9.2g的一组实验中盐酸过量 |
| D.15.7g混合物恰好与盐酸完全反应 |
试题篮
()