下列有关溶液中微粒的物质的量浓度关系正确的是 ( )
| A.1L0.1mol·L-1(NH4)2Fe(SO4)2溶液: c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-) |
| B.25℃时,等体积、等浓度的NaX和弱酸HX混合后的溶液中: c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-) |
| C.25℃时,BaCO3饱和溶液(Ksp =8.1×10-9): c(Ba2+)= c(CO32-)>c(H+) = c(OH-) |
| D.1.0 mol·L-1 Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) |
下述实验不能达到预期实验目的的是
| 序号 |
实验内容 |
实验目的 |
| A |
室温下,用pH试纸测定浓度为0.1mol·L-1NaClO溶液和0.1 mol·L-1CH3COONa溶液的pH |
比较HClO和CH3COOH的酸性强弱 |
| B |
向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液 |
说明一种沉淀能转化为另一种溶解度更小的沉淀 |
| C |
向NaAlO2溶液中滴加饱和NaHCO3溶液,有白色沉淀产生 |
验证两者都发生了水解反应,且相互促进 |
| D |
室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 |
研究浓度对反应速率的影响 |
下表是在相同温度下三种酸的一些数据,下列判断正确的是( )
| 酸 |
HX |
HY |
HZ |
||
| 浓度(mol/L) |
0.12 |
0.2 |
0.9 |
1 |
1 |
| 电离度 |
0.25 |
0.2 |
0.1 |
0.3 |
0.5 |
| 电离常数 |
K1 |
K2 |
K3 |
K4 |
K5 |
A.在相同温度,从HX的数据可以说明:弱电解质溶液,浓度越低,电离度越大,且K1>K2>K3=0.01
B.室温时,若在NaZ溶液中加水,则c(Z-)/ [c(HZ)• c(OH-)]的比值变小,若加少量盐酸,则比值变大
C.等物质的量的NaX、NaY和NaZ的混合,c(X-)+c(Y-)-2c(Z-)=2c(HZ)-c(HX)-c(HY),且c(Z-)<c(Y-)<c(X-)
D.在相同温度下,K5>K4>K3
下列溶液中微粒浓度关系一定正确的是
| A.室温时,氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(NH4+) |
| B.室温时,pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)=c(H+) |
| C.0.1 mol·L-1的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+) |
| D.0.1 mol·L-1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S) |
下列说法中正确的是
A.若M度T0C时水的离子积常数为KW在该温度下的中性溶液中c(H+)=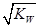 mol/L mol/L |
| B.25℃时HCl溶液中的c(H+)一定大于25℃时NH4Cl溶液中的c(H+) |
| C.1mol/LCH3COOH溶液和1mol • L-1KOH溶液等体积混合,混合溶液中c(K+)=c(CH3COO-) |
| D.pH =5.7的 NaHSO3溶液中:c(Na+)>c(HSO3-)>c(H2SO3)>c(SO32-) |
常温下,关于下列溶液的叙述错误的是
| A.CH3COOH分子可以存在于pH=8的碱性溶液中 |
| B.1mol/L氨水与0.5mol/L氨水中c(OH-)之比是2:1 |
| C.甲酸溶液和一定量NaOH溶液恰好完全反应,溶液中c(HCOO-)<c(Na+) |
| D.等体积等pH的醋酸和盐酸分别加水稀释至a mL和b mL,稀释后溶液pH均为5,则a>b |
(届江西省八校高三下学期联考理综化学试卷)
下列叙述或表示正确的是
| A.0.1 mol·L-1的醋酸的pH=a,0.01 mol·L-1的醋酸的pH=b,则a+1=b |
| B.常温下0.1 mol·L-1的醋酸溶液与等浓度等体积NaOH溶液反应后的溶液中:c(CH3COOH)+c(CH3COOˉ)="0.1" mol·L-1 |
| C.难溶电解质AB2的饱和溶液中,c(A2+)=xmol·L-1, c(B-)="y" mol·L-1,则Ksp值为4xy2 |
| D.用200mL4 mol·L-1的NaOH溶液将0.6mol CO2完全吸收,反应的离子方程式为:3CO2+4OHˉ=CO32ˉ+2HCO3ˉ+H2O |
25℃时,已知弱酸的电离常数:K(CH3COOH)=1.8×10-5;K1(H2CO3)=4.4×10-7;K2(H2CO3)=4.7×10-11;K(HClO)=4.0×10-8。则下列说法正确的是( )
| A.25℃时,0.1mol/L的醋酸溶液比0.01mol/L的醋酸溶液的K值小 |
| B.25℃时,甲基橙滴入0.1mol/L的醋酸溶液中,溶液呈黄色 |
| C.新制氯水与碳酸氢钠不反应 |
| D.等物质的量浓度的碳酸钠溶液、醋酸钠溶液、次氯酸钠溶液的pH:pH[Na2CO3(aq)]>pH[NaClO(aq)]>pH[CH3COONa(aq)] |
SO2的烟气会形成酸雨,工业上常利用Na2SO3溶液作为吸收液脱除烟气中的SO2。随着SO2的吸收,吸收液的pH不断变化。下列粒子浓度关系一定正确的是
| A.Na2SO3溶液中存在:c(Na+)>c(SO32-)>c(H2SO3)>c(HSO3-) |
| B.已知NaHSO3溶液pH<7,该溶液中:c(Na+)>c(HSO3-)>c(H2SO3) >c(SO32-) |
| C.当吸收液呈中性时:c(Na+)=2 c(SO32-)+c(HSO3-) |
| D.当吸收液呈酸性时:c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3) |
关于下列各图的叙述正确的是
A.甲中△H1=△H2+△H3
B.乙表示恒温恒容条件下发生的可逆反应2NO2 N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将tl℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH
下列图示与对应的叙述不相符的是
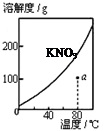
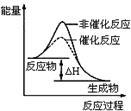
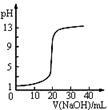
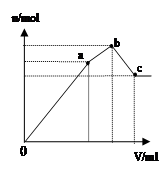
图1 图2 图3 图4
| A.图1表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液 |
| B.图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| C.图3表示0.1000mol•L-1NaOH溶液滴定20.00mL0.1000mol•L-1醋酸溶液得到的滴定曲线 |
| D.图4 表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化 |
下列叙述中正确的是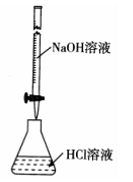
| A.根据上图,若滴定前仰视读数,滴定终点时俯视读数,则测定的盐酸浓度偏高 |
| B.25℃时,难溶物XY和AB3的KSP分别为1.0×10-10和2.7×10-15,则饱和溶液中C(X+)一定大于C(A3+) |
| C.每个Fe(OH)3胶体粒子含一个氢氧化铁分子 |
| D.某溶液中存在K+、HCO-3、CO2-3、OH-、H+,其离子浓度大小顺序可能为c(K+)>c(HCO-3)>c(H+)>c(CO32-) |
归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:归纳正确的是
①常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,则有c (Na+) + c(H+)=c(OH-) + c(CH3COO-)
②对已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,生成物的百分含量一定增加
③常温下,AgCl在同物质的量浓度的CaCl2和NaCl溶液中的溶解度相同
④常温下,已知醋酸电离平衡常数为Ka;醋酸根水解平衡常数为Kh;水的离子积为Kw;
则有:Ka·Kh=Kw
⑤电解精炼铜时,电解质溶液中铜离子浓度不变 。
| A.①④ | B.①②④ | C.①②④⑤ | D.①②③④ |
常温下,下列溶液中的微粒浓度关系正确的是( )
| A.新制氯水中加入固体NaOH:c(Na+) = c(Cl-) + c(ClO-) + c(OH‑) |
| B.pH = 8.3的NaHCO3溶液:c(Na+) > c(HCO3-) > c(CO32-) > c(H2CO3) |
| C.pH = 11的氨水与pH = 3的盐酸等体积混合:c(Cl-) = c(NH4+) > c(OH‑) = c(H+) |
| D.0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合: |
2c(H+) – 2c(OH-) = c(CH3COO-) – c(CH3COOH)
常温下体积相同的下列四种溶液:①pH=3的盐酸 ②pH=3的醋酸溶液 ③pH=11的氨水 ④pH=11的NaOH溶液。下列说法中,正确的是
| A.②和④混合,所得混合溶液的pH大于7 |
| B.将四种溶液分别稀释到体积为原的100倍,溶液pH大小顺序③>④>②>① |
| C.③和④分别与足量稀硫酸中和,消耗硫酸的体积③=④ |
| D.①和③混合,所得混合溶液中c(H+)+ c(NH4+)=c(Cl-)+c(OH-) |
试题篮
()