在一定温度下,将气体X和气体Y各0. 16 mol充入10 L恒容密闭容器中,发生反应X(g)+Y(g)  2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
| t/min |
2 |
4 |
7 |
9 |
| n(Y)/mol |
0.12 |
0.11 |
0.10 |
0.10 |
下列说法正确的是
A.0~2 min的平均速率v(Z)=2.0×10-3 mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡时v(正)< v(逆)
C.该温度下此反应的平衡常数K=144
D.其他条件不变,再充入0.2 mol Z,平衡时X的体积分数不变
某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g) + m Y(g) 3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
| A.m=2 |
| B.两次平衡的平衡常数相同 |
| C.X与Y的平衡转化率之比为1:1 |
| D.第二次平衡时,Z的浓度为0.4 mol·L-1 |
下面是某化学研究小组探究外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是

| A.①是其他条件一定时,反应速率随温度变化的图像,正反应ΔH<0 |
| B.②是在平衡体系的溶液中溶入少量KCl晶体后化学反应速率随时间变化的图像 |
| C.③是在有无催化剂存在下建立的平衡过程图像,a是使用催化剂时的曲线 |
| D.④是一定条件下,向含有一定量A的容器中逐渐加入B时的图像,压强p1>p2 |
对于化学反应的限度的叙述不正确的是( )
| A.任何可逆反应都有一定的限度 |
B.对于反应2SO2(g)+O2(g) 2SO3(g)只有达到限度时才有2v(O2)=v(SO3) 2SO3(g)只有达到限度时才有2v(O2)=v(SO3) |
C.对于反应2SO2(g)+O2(g) 2SO3(g)达到限度时,增大容器容积能减小正反应速率 2SO3(g)达到限度时,增大容器容积能减小正反应速率 |
| D.化学反应达到限度时,正逆反应速率相等 |
下列事实能用勒沙特列原理解释的是
①由H2、I2蒸气、HI组成的平衡体系加压后颜色变深
②实验室中用氯化钠固体与浓硫酸共热制取氯化氢气体
③用排饱和食盐水法收集Cl2
④温度控制在500℃有利于合成氨反应
⑤工业制取金属钾Na(l)+ KCl(l)  NaCl(l)+ K(g)选适宜的温度,使K成蒸气从反应混合物中分离出来
NaCl(l)+ K(g)选适宜的温度,使K成蒸气从反应混合物中分离出来
| A.②③⑤ | B.①③⑤ | C.②③④⑤ | D.①②③⑤ |
下列说法中,错误的是
| A.反应的平衡转化率能表示在一定温度和一定起始浓度下反应进行的限度 |
| B.金属在发生电化学腐蚀的过程中,总是作为原电池负极的金属被氧化而腐蚀 |
| C.如果某化学反应的△H和△S均小于0,则反应一定能自发进行 |
| D.SO2催化氧化时,加入过量O2时可提高SO2的转化率 |
在0.1 mol·L-1CH3COOH溶液中存在如下电离平衡:CH3COOH CH3COO-+H+,对于该平衡,下列叙述正确的是
CH3COO-+H+,对于该平衡,下列叙述正确的是
| A.加入水时,平衡向逆反应方向移动 |
| B.加入少量NaOH固体,平衡向正反应方向移动 |
| C.加入少量0.1 mol·L-1HCl溶液,溶液中c(H+)减小 |
| D.加入少量CH3COONa固体,平衡向正反应方向移动 |
下列事实不能用勒沙特列原理解释的有( )
①铁在潮湿的空气中容易生锈;
②实验室可用排饱和食盐水的方法收集氯气;
③常温下,将1mL pH=3的醋酸溶液加水稀释至100mL,测得其pH<5;
④钠与氯化钾共融制备钾Na(l)+KCl(l) K(g)+NaCl(l);
K(g)+NaCl(l);
⑤二氧化氮与四氧化二氮的平衡体系,加压后颜色加深.
| A.2个 | B.3个 | C.4个 | D.5个 |
在一密闭容器中进行如下反应:3H2(气)+N2(气) 2NH3(气),已知反应过程中某一时 刻 H2、N2、NH3的浓度分别为 0.3mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是( )
2NH3(气),已知反应过程中某一时 刻 H2、N2、NH3的浓度分别为 0.3mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是( )
| A.H2为 0.6mol/L、N2为 0. 2mol/L | B.NH3为 0.25mol/L |
| C.N2、NH3均为 0.15mol/L | D.NH3为 0.4mol/L |
可逆反应2SO2 (g)+ O2 (g)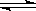 2SO3(g)达到平衡的标志是
2SO3(g)达到平衡的标志是
① 消耗2 mol SO2的同时生成2 mol SO3
②SO2、O2与SO3的物质的量之比为2∶1∶2
③ 反应混合物中,SO3的质量分数不再改变
| A.①② | B.①③ | C.只有③ | D.只有① |
在容积不变的密闭容器中,一定条件下发生反应:2A(?) B(g)+C(s),达到化学平衡后,升高温度,容器内气体的密度增大,则下列叙述正确的是( )
B(g)+C(s),达到化学平衡后,升高温度,容器内气体的密度增大,则下列叙述正确的是( )
| A.若正反应是吸热反应,则A为非气态 |
| B.若正反应是放热反应,则A为非气态 |
| C.在平衡体系中加入少量C,该平衡向逆反应方向移动 |
| D.改变压强对该平衡的移动一定无影响 |
对可逆反应A(g)+2B(g) 3C(g),在其他条件不变的情况下,下列有关叙述不正确的是( )
3C(g),在其他条件不变的情况下,下列有关叙述不正确的是( )
A.单位时间内消耗amol(A),同时消耗3amolC时,反应处于平衡状态
B.增大容器的体积,化学平衡不移动,反应速率也不变
C.升高温度使c(B)增大,可知正反应为放热反应
D.加入催化剂,改变了反应历程,但反应的△H不会变
将2molA与2molB混合于2L的密闭容器中发生如下反应:2A(g)+3B(g) 2C(g)+zD(g),2s后A的转化率为50%,测得v(D)=0.25mol•L-1•s-1,下列推断不正确的是( )
2C(g)+zD(g),2s后A的转化率为50%,测得v(D)=0.25mol•L-1•s-1,下列推断不正确的是( )
A.v(C)=v(D)=0.25mol•L-1•s-1 B.z=2
C.C的体积分数为28.6% D.B的转化率为25%
试题篮
()