用NH3催化还原NxOy可以消除氮氧化物的污染。
已知:反应I: 4NH3(g)+6NO(g)  5N2(g)+6H2O(l) △H1
5N2(g)+6H2O(l) △H1
反应II: 2NO(g)+O2(g)  2NO2(g) △H2(且|△H1| =2|△H2|)
2NO2(g) △H2(且|△H1| =2|△H2|)
反应III:4NH3(g)+6NO2(g)  5N2(g)+3O2(g)+6H2O(l) △H3
5N2(g)+3O2(g)+6H2O(l) △H3
反应I和反应II在不同温度时的平衡常数及其大小关系如下表
| 温度/K |
反应I |
反应II |
已知: |
| 298 |
K1 |
K2 |
|
| 398 |
K1′ |
K2′ |
(1)△H3 = (用△H1、△H2 的代数式表示);推测反应III是 反应(填“吸热”或“放热”)
(2)相同条件下,反应I在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示。

①计算0~4分钟在A催化剂作用下,反应速率v(NO)= 。
②下列说法不正确的是 。
A.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
B.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
C.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
D.增大压强能使反应速率加快,是因为增加了活化分子百分数
(3)一定条件下,反应II达到平衡时体系中n(NO)∶n(O2)∶n(NO2)=2∶1∶2。恒温恒压时,在其它条件不变时,再充入NO2气体, NO2体积分数 (填“变大”、“变小”或“不变”)
(4)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下,溶液中OH-向电极 移动(填a或b),负极的电极反应式为 。

炼油厂常将裂解产生的其它烯烃加氢,对产物再次裂解以提高乙烯产量。相关加成反应如下:
① (g)+H2(g)
(g)+H2(g)  CH3CH2CH2CH3(g) △H1
CH3CH2CH2CH3(g) △H1
② (g)+H2(g)
(g)+H2(g)  CH3CH2CH2CH3(g) △H2
CH3CH2CH2CH3(g) △H2
(1)已知反应①、反应②平衡常数K1、K2如下,下列叙述正确的是____;
| 温度(℃) |
300 |
320 |
340 |
| K1 |
4.8×10-4 |
2.5×10-4 |
1.3×10-4 |
| K2 |
8.4×105 |
3.5×103 |
1.6×103 |
A.△H1>0;△H2<0
B.反应①、反应②都是丙烯加氢,所以△H1=△H2
C.相同条件下反应②的转化率大于反应①的转化率
D.从平衡常数推测,相同条件下反应②的反应速率很大,反应①的反应速率很小
(2)2-丁烯的顺、反异构转换过程的△H=_______(用△H1、△H2表示)
 (g)
(g) 
 (g) △H
(g) △H
(3)在一定温度下,将等物质的量的反式2-丁烯和H2充入2L密闭容器中,发生反应②,容器内各物质浓度如图所示:

①前10分钟,平均反应速率v(H2)为______mol·L-1·min-1
②该温度下,此反应平衡常数K=_______(平衡常数不用写单位)
(4)已知表示H2和CH3CH2CH3标准燃烧热的热化学方程式为:
①H2(g)+ O2(g)
O2(g) H2O(l) △H=-285.8kJ•mol-1
H2O(l) △H=-285.8kJ•mol-1
②CH3CH2CH3(g)+5O2(g) 3CO2(g)+4H2O(l) △H=-2215kJ•mol-1
3CO2(g)+4H2O(l) △H=-2215kJ•mol-1
丁烯加成反应的热化学方程式为:
③CH3CH=CH2(g)+H2(g) CH3CH2CH3(g) △H=-125.4kJ•mol-1
CH3CH2CH3(g) △H=-125.4kJ•mol-1
则表示CH3CH=CH2标准燃烧热的热化学方程式为__________________。
80℃时,将0.40mol的N2O4气体充入2 L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4  2NO2,△H >0隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2,△H >0隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) n(mol) |
0 |
20 |
40 |
60 |
80 |
100 |
| n(N2O4) |
0.40 |
a |
0.20 |
c |
d |
e |
| n(NO2) |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |





 (1)计算0s—20s内用N2O4表示的平均反应速率为 mol·L-1·s-1
(1)计算0s—20s内用N2O4表示的平均反应速率为 mol·L-1·s-1

 (2)要增大N2O4的转化率,同时增大该反应的K值,可采取的措施有 (填序号)
(2)要增大N2O4的转化率,同时增大该反应的K值,可采取的措施有 (填序号)
 A.通入一定量的NO2气体
A.通入一定量的NO2气体
 B.通入一定量的氦气以增大压强
B.通入一定量的氦气以增大压强
 C.使用高效催化剂
C.使用高效催化剂
 D.升高温度
D.升高温度
 (3)如图是80℃时容器中N2O4物质的量的变化
(3)如图是80℃时容器中N2O4物质的量的变化 曲线,请在该图中补画出该反应在60℃时
曲线,请在该图中补画出该反应在60℃时 N2O4物质的量的变化曲线。
N2O4物质的量的变化曲线。

一定条件下合成乙烯:6H2(g)+2CO2(g) CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是:
CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是:
| A.生成乙烯的速率:v(M)有可能小于v(N) |
| B.平衡常数:KM>KN |
| C.当温度高于250℃,升高温度,平衡向逆反应方向移动,从而使催化剂的催化效率降低 |
| D.若投料比n(H2):n(CO2)=3:1,则图中M点时,乙烯的体积分数为7.7% |
(共12分)红矾钠(重铬酸钠:Na2Cr2O7·2H2O)是重要的化工原料,工业上用铬铁矿(主要成分是FeO·Cr2O3)制备红矾钠的过程中会发生如下反应:4FeO(s)+Cr2O3(s)+8Na2CO3(s)+7O2(g) 8Na2CrO4(s)+2Fe2O3(s)+8CO2(g) ΔH<0
8Na2CrO4(s)+2Fe2O3(s)+8CO2(g) ΔH<0
(1)请写出上述反应的化学平衡常数表达式:K=__________________。
(2)图1、图2表示上述反应在t1时达到平衡,在t2时因改变某个条件而发生变化的曲线。
由图1判断,反应进行至t2时,曲线发生变化的原因是________________(用文字表达);
由图2判断,t2到t3的曲线变化的原因可能是________(填写序号)。
a.升高温度 b.加了催化剂 c.通入O2 d.缩小容器体积

(3)工业上可用上述反应中的副产物CO2来生产甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g),
CH3OH(g)+H2O(g),
①已知该反应能自发进行,则下列图像正确的是________________

②在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变得情况下,考查温度对反应的影响,实验结果如图所示(注:T1、T2均大于300℃);下列说法正确的是______(填序号)

A.温度为T1时,从反应开始到平衡,生成甲醇的平均速率:v(CH3OH)= mol·L-1·min-1 mol·L-1·min-1 |
| B.该反应在T1时的平衡常数比T2时的小 |
| C.该反应为放热反应 |
D.处于A点的反应体系从T1变到T2,达到平衡时 增大 增大 |
③在T1温度时,将1molCO2和3molH2充入一密闭恒容器中,充分反应达到平衡后,CO2转化率为a,则容器内的压强与起始压强之比为___________。
甲醇是一种重要的化工原料,在生产中有着重要的应用。工业上用天然气为原料,分为两阶段制备甲醇:
(ⅰ)制备合成气:CH4(g)+H2O(g) CO(g)+3H2(g)
CO(g)+3H2(g) 
(ⅱ)合成甲醇:CO(g)+2H2(g) CH3OH(g)
CH3OH(g) 
请回答下列问题:
(1)制备合成气:将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应(i);CH4的平衡转化率与温度、压强的关系如图所示。

①已知100℃时达到平衡的时间为5min,则从反应开始到平衡,用氢气表示的平均反应速率为:v(H2)= 。
100℃时该反应的平衡常数K= ;若升高温度,平衡常数K将 (填“增大”、“减小”或“不变”)。
②图中p1 p2(填“<”、”“>”或“=”)。
③为解决合成气中H2过量而CO不足的问题,原料气中需添加CO2,发生反应如下:CO2(g)+H2(g) CO(g)+H2O(g),为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为 。
CO(g)+H2O(g),为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为 。
(2)合成甲醇:在Cu2O/ZnO作催化剂的条件下,向2L的密闭容器中通入1mol
CO(g)和2mol H2(g),发生反应(ⅱ)。
①反应(ⅱ)需在 (填“高温”或“低温”)才能自发进行。
②据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量的CO2 有利于维持Cu2O的量不变,原因是_________________(用化学方程式表示)。
(16分)FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:(16分)
(1)FeCl3净水的原理是 。FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示) 。
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。
①若酸性FeCl2废液中各离子浓度如下:则该溶液的pH约为 。
c(Fe2+)=2.0×10-2mol·L-1,c(Fe3+)=1.0×10-3mol·L-1, c(Cl-)=5.3×10-2mol·L-1,
②NaClO3能在酸性条件下氧化FeCl2,写出离子方程式:
(3)FeCl3在溶液中分三步水解:
Fe3++H2O  Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++H2O Fe(OH)2++H+ K2
Fe(OH)2++H+ K2
Fe(OH)++H2O Fe(OH)3+H+ K3
Fe(OH)3+H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是 。
通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为: xFe3++yH2O Fex(OH)y(3x-y)++yH+
Fex(OH)y(3x-y)++yH+
欲使平衡正向移动可采用的方法是(填序号) 。
a.降温 b.加水稀释 c.加入NH4Cl d.加入NaHCO3
室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是 。
(4)天津某污水处理厂用氯化铁净化污水的结果如下图所示。

由图中数据得出每升污水中投放聚合氯化铁[以Fe(mg·L-1)表示]的最佳范围约为 mg·L-1。
Ⅰ、工业上设计用CO2来生产燃料甲醇,既减少二氧化碳气体,又得到宝贵的能源物质。为了探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1molCO2和3molH2,某温度下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0KJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示
CH3OH(g)+H2O(g)△H=-49.0KJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示

(1)该反应该温度下,化学平衡常数的值为_______________________
(2)下列说法中能作为反应达到平衡状态标志的是___________________(填字母)。
A.容器内压强不再发生变化
B.平均相对分子质量不再变化
C.c(CO2)和c(H2)之比等于1:3
D.相同时间内每断裂3molH-H键,同时断裂3molO-H键
(3)下列措施中能使n(CH3OH)/n(CO2)减小的是__________________
A.再充入1molCO2和3molH2 B.将H2O(g)从体系中分离
C.充入He(g),使体系压强增大 D.升高温度
Ⅱ、钢铁工业是国家工业的支柱,每年钢铁生锈让国家损失大量资金,请回答钢铁腐蚀与防护过程中的有关问题。
(1)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如下:

①A电极对应的金属是_________(写元素名称),B电极的电极反应式是__________;
②若电镀前铁、铜两片金属质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12g,则电镀时电路中通过的电子为__________;
③镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因___________________________。
“洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了高热值的煤炭气,其主要成分是CO和H2。CO和H2可作为能源和化工原料,应用十分广泛.生产煤炭气的反应之一是:C(s)+H2O(g) CO(g)+H2(g) H=+131.4kJ/mol
CO(g)+H2(g) H=+131.4kJ/mol
(1)在容积为3L的密闭容器中发生上述反应,5min后容器内气体的密度增大了0.12g/L,用H2O表示0~5min的平均反应速率为______________。
(2)关于上述反应在化学平衡状态时的描述正确的是___________.
A.CO的含量保持不变
B.v正(H2O)=v正(H2)
C.容器中混合气体的平均相对分子质量保持不变
(3)若上述反应在t0时刻达到平衡(如图),在t1时刻改变某一条件,请在图中继续画出t1时刻之后正反应速率随时间的变化:
①缩小容器体积,t2时到达平衡(用实线表示);
②t3时平衡常数K值变大,t4到达平衡(用虚线表示).
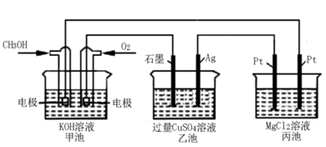
(4)在一定条件下用CO和H2可以制得甲醇,CH3OH和CO的燃烧热分别为725.8kJ/mol,283.0kJ/mol,1molH2O(l)变为H2O(g)吸收44.0 kJ的热量,写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式_______________________
(5)如下图所示,以甲醇燃料电池作为电源实现下列电解过程.乙池中发生反应的离子方程式为_____________。当甲池中增重16g时,丙池中理论上产生沉淀质量的最大值为_________g。
在20L的密闭容器中按物质的量之比1:2充入CO和H2,发生:CO(g)+2H2(g) CH3OH(g)△H。测得平衡时CO的转化率随温度及不同压强下的变化。P2和195℃时n(H2)随时间的变化结果如表格所示。下列说法正确的是
CH3OH(g)△H。测得平衡时CO的转化率随温度及不同压强下的变化。P2和195℃时n(H2)随时间的变化结果如表格所示。下列说法正确的是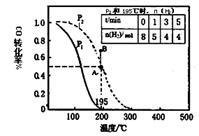
| A.0~3 min,平均速率v(CH3OH)="0.8" mol•L-1•min-1 |
| B.P1<P2,△H<0 |
| C.在P2及195℃时,该反应的平衡常数为25 |
| D.在B点时,v(正)>v(逆) |
大气污染越来越成为人们关注的问题,烟气中的NOx必须脱除(即脱硝)后才能排放。
(1)已知:CH4(g)+2O2(g)===CO2(g)+2H2O(1) ΔH=-890.3 kJ·mol-1
N2(g)+O2(g)==="2NO(g)" ΔH=+180 kJ·mol-1
CH4可用于脱硝,其热化学方程式为:CH4(g)+4NO(g)=CO2(g)+2N2(g)+2H2O(1),ΔH=________。
(2)C2H4也可用于烟气脱硝。为研究温度、催化剂中Cu2+负载量对NO去除率的影响,控制其它条件一定,实验结果如图1所示。为达到最高的NO去除率,应选择的反应温度和Cu2+负载量分别是___________________________。

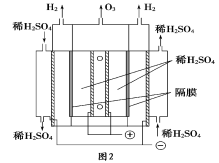
(3)臭氧也可用于烟气脱硝。
①O3氧化NO 结合水洗可产生HNO3和O2,该反应的化学方程式为______________。
②一种臭氧发生装置原理如图2所示。阳极(惰性电极)的电极反应式为___________。
(4)如图3是一种用NH3脱除烟气中NO的原理。

①该脱硝原理中,NO最终转化为________(填化学式)和H2O。
②当消耗2molNH3和0.5molO2时,除去的NO在标准状况下的体积为_____________。
(5)NO直接催化分解(生成N2与O2)也是一种脱硝途径。在不同条件下,NO的分解产物不同。在高压下,NO在40 ℃下分解生成两种化合物,体系中各组分物质的量随时间变化曲线如图4所示。写出Y和Z的化学式: _____________________________。
在体积均为1.0L的两个恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s) 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是( )
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是( )

A.反应CO2(g)+c(s) 2CO(g) △S>0、△H<0 2CO(g) △S>0、△H<0 |
| B.体系的总压强P总:P总(状态Ⅱ)>2P总(状态Ⅰ) |
| C.体系中c(CO):c(CO,状态Ⅱ) >2c(CO,状态Ⅲ) |
| D.逆反应速率V逆:V逆(状态Ⅰ)>V逆(状态Ⅲ) |
运用化学反应原理研究部分单质及其化合物的反应有重要意义。
 (1)氨是氮循环过程中的重要物质,是氮肥工业的重要原料。氨的合成目前普遍使用的人工固氮方法:N2(g)+3H2(g)
(1)氨是氮循环过程中的重要物质,是氮肥工业的重要原料。氨的合成目前普遍使用的人工固氮方法:N2(g)+3H2(g)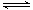 2NH3(g)。请回答:
2NH3(g)。请回答:
①已知:H-H键能为436kJ/mol,N N键能为945kJ/mol,N一H键能为391kJ/mol.由键能计算消耗1molN2时的△H=_________。若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡_______移动(填“向左”、“向右”或“不”);
②如图中:当温度由T1变化到T2时,KA______KB(填“>”、“<”或“=”)。
(2)氨气溶于水得到氨水。NO2可用氨水吸收生成NH4NO3,25℃时,将amolNH4NO3溶于水,溶液显酸性,原因是___________(用离子方程式表示),向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将__________(填“正向”、“不”或“逆向”)移动,所滴加氨水的浓度为________mol/L(用含a、b的代数式表示),(NH3·H2O的电离平衡常数取Kb=2×10-5mol/L)
(3)硫酸生产中,SO2催化氧化生成SO3:SO2(g)+1/2O2(g)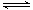 SO3(g)△H<0,是工业上生产硫酸的关键步骤。
SO3(g)△H<0,是工业上生产硫酸的关键步骤。
①在某温度时,该反应的平衡常数K=0.75,若在此温度下,向100L的恒容密闭容器中,充入3mol SO2、4mol O2和4mol SO3,则反应开始时正反应速率________逆反应速率(填“<”、“>”或“=”)。
②在①中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是________。
a.保持温度和容器体积不变,充入1.0mol SO3(g)
b.保持温度和容器内压强不变,充入2.0mol He
c.降低温度
d.在其他条件不变时,减小容器的容积
③由硫酸可制得硫酸盐.在一定温度下,向K2SO4溶液中滴加Na2CO3溶液和BaCl2溶液,当两种 沉淀共存时,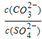 =_________。
=_________。
[已知该温度时,Ksp(BaSO4)=1.3×10-10,Ksp(BaCO3)=5.2×10-9]
在3个2 L的密闭容器中,在相同的温度下、使用相同的催化剂分别进行反应:3H2(g)+N2(g)  2NH3(g)。按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
2NH3(g)。按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下: 
下列说法不正确的是( )
| A.容器乙中反应从开始到达平衡的反应速率为v(H2)=0.3mol·L-1·min-1 |
| B.2c1<1.5 |
C.在该温度下甲容器中反应的平衡常数K= |
| D.2ρ1=ρ2 |
运用化学反应原理研究氮、硫等单质及其化合物的反应有重要意义。
(1)硫酸生产过程中2SO2(g)+O2(g) 2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如图所示,根据下图回答下列问题:
2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如图所示,根据下图回答下列问题:

①2SO2(g)+O2(g) 2SO3(g)的△H______0(填“>”或“<”)。
2SO3(g)的△H______0(填“>”或“<”)。
②一定条件下,将SO2与O2以体积比2:1置于一体积不变的密闭容器中发生以上反应,能说明该反应已达到平衡的是___________(填字母编号)。
a.体系的密度不发生变化
b.SO2与SO3的体积比保持不变
c.体系中硫元素的质量百分含量不再变化
d.单位时间内转移4 mol 电子,同时消耗2 mol SO3
e.容器内的气体分子总数不再变化
(2)一定的条件下,合成氨反应为:N2(g)+3H2(g) 2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。

①该反应的平衡常数表达式为 ,升高温度,平衡常数 (填“增大”或“减小”或“不变”)。
②由图2信息,计算0~10min内该反应的平均速率v(H2)= ,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为 (填“a”或“b”或“c”或“d”)。
③图3 a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是 点,温度T1 T2(填“>”或“=”或“<”)
(3)若将等物质的量的SO2与NH3溶于水充分反应,所得溶液呈 性,所得溶液中c(H+)- c(OH-)= (填写表达式)(已知:H2SO3:Ka1=1.7×10-2,Ka2=6.0×10-8,NH3·H2O:Kb=1.8×10-5)。
试题篮
()