汽车尾气(含有烃类、CO、SO2与NO等物质)是城市空气的污染物,治理的方法之一是在汽车的排气管上装上“催化转换器”(用钯、铂合金作催化剂)。它的特点是使 CO与NO反应,生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧及SO2的转化。
(1)写出CO与NO反应的化学方程式____________________。
(2)“催化转换器”的缺点是在一定程度上提高了空气的酸度。其原因是___________________。
(3)控制城市污染源的方法可以有___________________。
我国北方春天在播种时,种子下地后往往在土壤上面覆盖上塑料薄膜,其主要作用是 ,体现了塑料薄膜具有 性质。
小玲到了傍晚时就看不见东西,患了夜盲症。可能的原因之一是她的体内缺乏维生素 ;小可同学近期感到精神不振、疲劳、头晕、面色苍白,医生说她患了贫血病,此时她应该多补充蛋白质和含__________丰富的无机盐。
已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为__________,该元素的符号是__________;
(2)Z元素位于元素周期表________区,目前该元素发现________种同位素;
(3)X与Z可形成化合物XZ3,该化合物的空间构型为__________;
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是__________;
(5)X的氢化物与同族第二、第三周期元素所形成的氢化物沸点由高到低顺序是(用化学式表示)______.
回答下问题:
(1)C、N、O三种元素的第一电离能由大到小的顺序是__________________。
(2)C、Si、N的电负性由大到小的顺序是__________________。
(3)氟化氢水溶液中存在的氢键有_________种。
(4)金属镍及其化合物在合金材料以及催化剂等方面应用广泛,Ni的基态原子有________种能量不同的电子。很多不饱和有机物在Ni催化下可以H2发生加成反应。如①CH2=CH2、②HC≡CH、③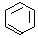 、④HCHO,其中碳原子采取sp2杂化的分子有__________(填物质编号),HCHO分子的立体构型为______________。
、④HCHO,其中碳原子采取sp2杂化的分子有__________(填物质编号),HCHO分子的立体构型为______________。
回答下问题:
(1)下列说法不正确的是______________(填字母序号)。
| A.铝的氧化物属于碱性氧化物 |
| B.光纤制品的基本原料为SiO2 |
| C.用热的纯碱溶液洗涤沾有油污的器具时发生的主要是化学变化 |
| D.液氨、液氯、液态氯化氢都是非电解质 |
E.丁达尔效应可用于区别溶液与胶体,云、雾均能产生丁达尔效应
F.化学变化前后原子的种类、数目不变,分子数目也不变
(2)出土的青铜器大多受到魂晶腐蚀,某青铜器中Sn、Pb的质量分别为119g、20.7g,则该青铜器中Sn和Pb原子的数目之比为______________。采用“局部封闭法”可以防止青铜器进一步被腐蚀。如将糊状Ag2O涂在被腐蚀部位,Ag2O与有害组分CuCl发生复分解反应,该化学方程式为____________。
(3)KNO3中NO3-的空间构型为__________,写出与NO3-互为等电子体的另一种阴离子的化学式:__________。
(4)已知配合物CrCl3·6H2O中心原子Cr3+配位数为6,向含0.1molCrCl3·6H2O的溶液中滴加2mol/LAgNO3溶液,反应完全后共消耗AgNO3溶液50mL,则该配离子的化学式为________。
研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) K1 ∆H < 0(I)
NaNO3(s)+ClNO(g) K1 ∆H < 0(I)
2NO(g)+Cl2(g) 2ClNO(g) K2 ∆H < 0 (II)
2ClNO(g) K2 ∆H < 0 (II)
(1)4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向 2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。测得10min内V(ClNO)=7.5×10-3mol•L-1•min-1,则平衡后n(Cl2)= mol,NO的转化率а1= 它条件保持不变,反应(II)在恒压条件下进行,平衡时NO的转化率а2 а1(填“>”“<”或“=”),平衡常数K2 (填“增大”“减小”或“不变”)。若要使K2减小,可采用的措施是 。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得 1L溶液A,溶液B为0.1mol•L‾1的CH3COONa溶液,则两溶液中c(NO3‾)、c(NO2-)和c(CH3COO‾)由大到小的顺序为 。(已知HNO2的电离常数Ka=7.1×10-4mol•L‾1,CH3COOH的电离常数Ka=1.7×10-5mol•L‾1,可使溶液A和溶液B的pH相等的方法是 。
| A.向溶液A中加适量水 | B.向溶液A中加适量NaOH |
| C.向溶液B中加适量水 | D.向溶液B中加适量NaOH |
(4)在25℃下,将a mol•L﹣1的氨水与0.01mol•L﹣1的盐酸等体积混合,反应时溶液中c(NH4+)=c(Cl﹣).则溶液显 (填“酸”“碱”或“中”)性;用含a的代数式表示NH3•H2O的电离常数Kb= 。
(5)水溶液中的行为是中学化学的重要内容.已知下列物质的电离常数值:
HClO:Ka=3×10﹣8 HCN:Ka=4.9×10﹣10 H2CO3:Ka1=4.3×10﹣7 Ka2=5.6×10﹣11
84消毒液(有效成份为NaClO)中通入少量的CO2,该反应的化学方程式为 。
(1)室温下,有一pH=12的NaOH溶液100mL,欲使它的pH降为11。
①如果加入蒸馏水,就加入________mL
②如果加入pH=10的NaOH溶液,应加入_________mL
③如果加入0.008mol/LHCl溶液,应加入__________mL
(2)实验室在配制溶液时,一些物质存在水解的情况,如在配制Na2CO3溶液时,CO32-会水解,请书写水解离子方程式,在配制Al2(SO4)3溶液时,Al3+也存在水解,请书写水解离子方程式,为了防止Al2(SO4)3发生水解,可加入少量的。
(3)工业上用氧化铜制备氯化铜时,先将制的氧化铜(含有杂质FeO)用浓酸溶解得到的氯化铜(溶液中含有一定量的Fe2+)。
| 金属离子 |
pH值 |
|
| 开始沉淀 |
完全沉淀 |
|
| Fe2+ |
7.6 |
9.6 |
| Cu2+ |
4.4 |
6.4 |
| Fe3+ |
2.7 |
3.7 |
实际生产中先用次氯酸钠将Fe2+氧化成Fe3+,然后用试剂将溶液pH值调至 ~ ,即可除去铁杂质。
将0.8 mol I2(g)和1.2 mol H2(g)置于某1L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)  2HI(g)并达到平衡。HI的体积分数随时间的变化如表格所示:
2HI(g)并达到平衡。HI的体积分数随时间的变化如表格所示:
| HI体积分数 |
1min |
2min |
3min |
4min |
5min |
6min |
7min[ |
| 条件I |
26% |
42% |
52% |
57% |
60% |
60% |
60% |
| 条件II |
20% |
33% |
43% |
52% |
57% |
65% |
65% |
(1)在条件I到达平衡时,计算该反应的平衡常数K,要求列出计算过程。
(2)在条件I从开始反应到到达平衡时,H2的反应速率为____________。
(3)为达到条件II的数据,对于反应体系可能改变的操作是_______________。
(4)该反应的△H__________0(填">","<"或"=")
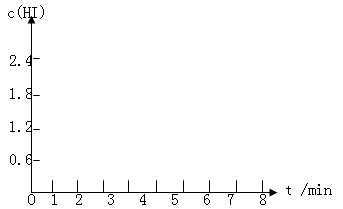
(5)在条件I下达到平衡后,在7min时将容器体积压缩为原来的一半。请在图中画出c(HI)随时间变化的曲线。
(1)氨的合成是最重要的化工生产之一,工业上合成氨用的H2有多种制取的方法。用天然气跟水蒸气反应:CH4(g)+H2O(g) CO(g)+3H2(g)。已知有关反应的能量变化如下图所示,则此制取H2反应的ΔH=____________。
CO(g)+3H2(g)。已知有关反应的能量变化如下图所示,则此制取H2反应的ΔH=____________。

(2)已知通常状况下,每充分燃烧1gCO并恢复到原状态,会释放10KJ的热量。请写出表示CO燃烧热的热化学反应方程式: 。
(3)一种甲烷燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接通入甲烷,同时向一个电极通入空气。此电池的正极电极反应式是__________________。
(4)利用右图装置可以模拟铁的电化学防护。

①若X为碳棒,为减缓铁的腐蚀,开关K应置于 处。
假设海水中只有NaCl溶质,写出此时总离子反应方程式:
②若X为锌,开关K置于M处,该电化学防护法称为 。写出铁电极处的电极反应式:____________。
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选用酚酞作指示剂。请填写下列空白:
(1)酸式滴定管用蒸馏水洗涤后,直接注入标准盐酸溶液进行滴定,则测得的结果________(填“偏高”、“偏低”或“无影响”)。
(2)滴定时边滴边摇动锥形瓶,眼睛应观察____________。
A. 滴定管内液面的变化 B. 锥形瓶内溶液颜色的变化
(3) 滴定结果如下表所示:
| 滴定次数 |
待测溶液NaOH的 体积/mL |
标准盐酸溶液的体积/mL |
|
| 滴定前刻度 |
滴定后刻度 |
||
| 1 |
25.00 |
0.00 |
26.11 |
| 2 |
25.00 |
1.56 |
30.30 |
| 3 |
25.00 |
0.22 |
26.31 |
若盐酸标准溶液的浓度为0.1000 mol·L-1,则该NaOH溶液的物质的量浓度为_________ mol·L-1。
常温下,将0.01 mol CH3COONa 和0.002 molHCl溶于水,形成1L混合溶液:
(1)该溶液中存在三个平衡体系,用电离方程式或离子方程式表示①和②:
① 。
② 。
③CH3COOH CHCOO-+H+。
CHCOO-+H+。
(2)溶液中共有 种不同的粒子(指分子和离子),在这些粒子中,浓度为0.01 mol/L的是 ,浓度为0.002 mol/L的是 。
(3)在上述溶液中,存在的两个守恒关系是:
①物料守恒,C(CH3COO-)+C(CH3COOH)= mol/L;
②电荷守恒,即: 。
物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡。请根据所学知识回答下列问题:
(1)NaHCO3溶液中共存在7种微粒,它们是Na+、HCO3-、H+、CO32-、H2O、 、 。(填写微粒符号)
(2)常温下,物质的量浓度均为0.1mol/L的六种溶液①NH4NO3、②NaCl、③NaClO、④H2SO4、⑤NaOH、⑥CH3COONa,pH从大到小排列顺序为 。(填写溶液的序号)
(3)常温时,AlCl3的水溶液呈 (填“酸”、“中”、“碱”)性,原因是(用离子方程式表示): ;把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
(4)常温下,物质的量浓度相同的下列溶液 :①NH4Cl、② (NH4)2SO4、 ③NH3·H2O ④ (NH4)2CO3、⑤ NH4HSO4。溶液中c(NH4+)从大到小的顺序为: 。(填写溶液的序号)
下图所示水槽中的试管内有一枚铁钉(含少量的炭),放置数天后观察:

(1)若试管内液面上升,则铁钉发生了 腐蚀,
正极反应式为 。
(2)若试管内的液面下降,则铁钉发生了 腐蚀,
负极反应式为 ,正极反应式为 。
(1)常说的三大合成材料包括塑料、____________和_____________。
(2)某些废弃的塑料通过分类、清洗、再加热熔融,可重新成为制品,这类塑料属于_________(填“热塑性”或“热固性”)塑料。
(3)CO中毒是因为CO与血红蛋白结合的能力远远大于_________(填一种气体名称)与血红蛋白结合的能力,导致人窒息。
(4)下列属于塑料制品的是_________(填序号),属于合成纤维的是_________(填序号)
A 聚乙烯制品 B 汽车轮胎 C 玻璃钢 D 涤纶 E 羊毛
(5)较多量的轻金属盐如饱和的Na2SO4溶液可使蛋白质产生__________(填“盐析”或“变性”)
试题篮
()