饮用可乐时,小华对“二氧化碳的溶解性”产生了兴趣,并进行了探究。
【查阅资料】二氧化碳能溶于水。在通常情况下,1体积的水约能溶解1体积的二氧化碳。二氧化碳溶于水,既有物理变化,又有化学变化,发生化学变化的化学方程式: 。
【提出问题】在实验室条件下,1体积的水究竟能溶解多少体积的二氧化碳呢?
【进行实验】
⑴ 将蒸馏水煮沸后,置于细口瓶中,盖上瓶塞,冷却至室温,备用。将蒸馏水煮沸的目的是 。
⑵ 制取二氧化碳,用向上排空法收集,验满后盖上玻璃片,备用。检验二氧化碳是否集满的操作方法
是 。
⑶ 实验①:取2支医用注射器分别抽取10mL空气和10mL备用的蒸馏水,用胶管连接(如图所示),交替推动2支注射器的活塞,反复多次。
实验②:取2支医用注射器分别抽取10mL现制的二氧 化碳气体和10mL备用的蒸馏水,用胶管连接(如图所示),交替推动2支注射器的活塞,反复多次至体积不再减少为止。反复交替推动注射器活塞的作用是________________________________________。
⑷ 记录数据:
| 实验编号 |
抽取气体的体积 |
抽取蒸馏水的体积 |
充分混合后,气、液总体积 |
| |
10 mL空气 |
10 mL |
20mL |
| |
10 mL现制的二氧化碳 |
10 mL |
12 mL |
【得出结论】由上表所列数据可知,在实验室条件下,空气难溶于水,二氧化碳的溶解性为1体积水最多能溶解 体积的二氧化碳。
【注意:若答对本小题奖励4分,化学卷总分不超过60分。】
【反思质疑】小芳对实验②注射器内不能再溶的气体产生了疑问:这种不能再溶的气体是空气还是二氧化碳气体? 若收集二氧化碳时空气未完全排尽,也可能导致实验②的残留气体是空气,就不能再溶,则实验结论不可信。请你设计一个方案探究以上所得实验结论是否可信。写清操作步骤、现象及结论。
小明参观某养鱼池时,好奇的发现农民向养鱼池中撒一种淡黄色固体——过氧化钙,用来增加鱼池中的含氧量。
小明刚学完氧气的实验室制法,于是他想可否用过氧化钙制取氧气。
【提出问题】过氧化钙可否用于制取氧气?
【查阅资料】部分内容如下:过氧化钙(CaO2)室温下稳定,在300℃时分解生成氧气,主要用途可做增氧剂、杀菌剂等。
【猜想与验证】
(1)小明依据资料显示:加热过氧化钙可制取氧气。
| 实验装置 |
实验主要过程 |
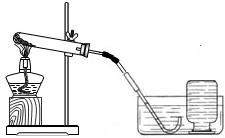 |
①检查装置气密性。操作如下:先将导管伸入液面下,用手紧握试管,观察到________,松开手后,导管口有液面上升。 ②加入过氧化钙,加热,当 ,开始收集氧气。 ③收集满一瓶气体,并将集气瓶 (填“正放”或“倒放”)在桌上。 ④停止加热。熄灭酒精灯前,应______________。 ⑤检验气体。方法是________________________。 |
实验结论:加热过氧化钙可制取氧气。
(2)小明联想到农民用过氧化钙增加鱼池中的含氧量,提出猜想Ⅱ.
猜想Ⅱ:过氧化钙与水反应可制取氧气。
| 实验装置 |
实验主要过程 |
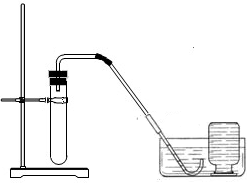 |
①检查装置气密性。 ②加入过氧化钙和水后,有少量细小气泡缓慢放出。 ③在导管口几乎收集不到气体。 该装置放置到第二天,集气瓶中只收集到极少量气体,振荡试管后仍有少量细小气泡缓慢放出。 |
实验结论:不能用过氧化钙与水反应制取氧气。
分析与反思:
虽然没有快速收集到大量氧气,但由此实验现象,小明推导出农民用过氧化钙做增氧剂的主要原因是 。
(3)小明希望对此实验进行改进,使该反应加快,你能帮他提出建议吗?
你的合理建议: 。
这些建议是否可行,还需进一步通过实验验证。
将一定量的石灰石放入烧杯中,加入一定量的稀盐酸,恰好完全反应,产生4.4g气体,反应后所得溶液的溶质的质量分数为20%.(杂质不溶于水,也不参与反应)计算:反应前稀盐酸的溶质的质量分数.(结果精确到0.1%)
(某白色固体可能含有氯化钠、硫酸钠、碳酸钠中的一种或几种,现将该固体溶于水配成溶液后,甲同学进行了验证实验,过程如下: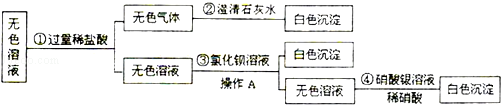
(1)由甲同学的实验过程可知,该白色固体中含有 _________ .(填名称,下同)写出无色气体与澄清石灰水反应的化学方程式 _________ .
(2)乙同学经过研究改换了上述实验中的①③两种试剂,除实验现象与甲同学的完全相同外,还将白色固体的成分确定了,则乙同学是把试剂①换成了 _________ ;把试剂③换成了 _________ ,该白色固体的组成 _________ .
初中常见A、B、C、D、E五种物质中均含铜元素,它们之间的相互转化关系如图.已知A在空气中加热生成黑色物质B;E溶液与铁反应可得到A,与氯化钡溶液反应可得到D,同时有白色沉淀生成;D溶液中加入少量的氢氧化钠溶液得到C,结合信息推断:
(1)B的化学式是 _________ .
(2)D→C的反应基本类型是 _________ .
(3)写出以下转化的化学方程式:
C→E: _________ ;
E→A: _________ ;
E→D: _________ .
(7分) 工业上常用稀盐酸处理铁制品表面的铁锈,据此请回答下列问题:
(1)除去铁锈的过程中还可以看到的一项实验现象是______________________________;
(2)如果稀盐酸用量太多就会看到有气泡产生,用化学方程式说明原因:
____________________________________________;
(3)工业上用了30千克溶质质量分数为7.3%的稀盐酸,与某铁制品表面的铁锈恰好完全反应,求反应后溶液的质量。(计算结果精确到小数点后一位)
实验室常用的干燥剂“碱石灰”是CaO和固体NaOH的混合物,极易与空气中水蒸汽和CO2反应而变质。某同学对一瓶久置的“碱石灰”作了如下探究:
(1)猜想:
猜想Ⅰ:没有变质,“碱石灰”只含有CaO、固体NaOH;
猜想Ⅱ:已完全变质,“碱石灰”全部变成了CaCO3和Na2CO3。
则CaO与水反应的反应方程式为 。
(2)实验:如图所示: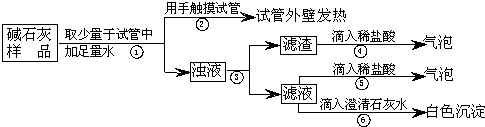
(3)判断:
a. 若Ca(OH)2、CaCO3和Na2CO3投入到水中不会放热,则由操作②现象判断:猜想Ⅱ
(填:成立、不成立)
b. 操作④发生化学反应的方程式为 ;由操作⑤⑥的现象判断:滤液中含有
(写化学式);由此判断猜想Ⅰ (填:成立、不成立)。
c. 综合a和b的结论,判断该样品变质情况为 。
(4)拓展:由上述实验说明,实验室中“碱石灰”应 保存;操作③中玻棒的作用是 。
某九年级化学活动小组同学设计了一个小游戏——物质接龙即他们之间存在着顺时针转化的关系。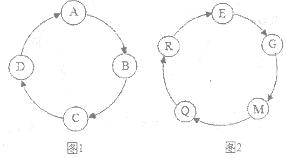
(1)A、B、C、D分别是初中化学常见的四种物质,如图1所示。若其中A能够供给动植物呼吸,C能参与植物光合作用,且A、B、C、D都含有相同的某一种元素,则A的化学式为 ,写出D→A、A→B的化学反应方程式 、 。
(2)小明同学觉得这个游戏很有趣,于是设计了图2的反应关系图,其中E、G、M、Q、R也都是初中化学常见的物质。若E的相对分子质量为100,Q是一种最常见的溶剂,则写出符合下列要求的化学方程式:
R→E: ,反应基本类型:复分解反应。
E→G: ,反应基本类型:分解反应。
硫酸亚铁铵晶体俗名为摩尔盐,化学式为xFeSO4·y(NH4)2SO4·zH2O,在制药、电镀方面有广泛的应用。
资料: ①硫酸亚铁铵晶体易溶于水,不溶于乙醇;
②相关物质的溶解度(单位:g)如下表:
| 温度/℃ |
FeSO4 |
(NH4) 2SO4 |
xFeSO4·y(NH4)2SO4·zH2O |
| 10 |
20.0 |
73 |
17.2 |
| 20 |
26.5 |
75.4 |
21. 6 |
| 30 |
32.9 |
78 |
28.1 |
③硫酸亚铁铵晶体受热时,在200℃以下只有结晶水失去。
【探究一】:制备硫酸亚铁铵晶体

某兴趣小组的学生用含有少量铜的废铁屑制备硫酸亚铁铵晶体,流程如下:
(1)在盛有废铁屑的容器中,倒入热水和洗涤剂,充分搅拌。以除去废铁屑表面的油污,这是利用洗涤剂的 作用;
(2)操作①中发生反应的化学方程式为 ;
(3)过滤所需的玻璃仪器有烧杯、玻璃棒、 。过滤操作中滤纸有多种折法,为了加快过滤速率,你选择折法是 ;

(4)操作①中过滤时,要趁热进行的原因是 ,过滤后得到的固体中一定含有的物质是 ;
(5)操作②的目的是得到硫酸亚铁铵晶体。操作顺序是b→ → →d;
a.过滤 b.加热浓缩 c.冷却结晶 d.洗涤干燥
(6)操作②中使用乙醇洗涤,可快速晾干。这样做的优点是 ;
A、避免用水洗涤所造成的晶体损耗
B、酒精易挥发,可低温晾干晶体
【探究二】:探究硫酸亚铁铵的组成
【实验步骤】:取2份等质量的硫酸亚铁铵晶体,分别进行实验。向一份中加入过量的NaOH溶液,充分反应后得到0.68gNH3;向另一份中加入过量的BaCl2溶液,充分反应后过滤、洗涤、干燥得到9.32g沉淀。
回答下列问题:
(7)实验中生成的NH3能使湿润的 变蓝;写出(NH4)2SO4与NaOH反应的化学方程式 ,属于 反应;
(8)实验中加入过量BaCl2溶液的目的 ;
(9)取最后一次洗涤液,加入Na2SO4溶液, ,则说明沉淀已经洗涤干净;
(10)根据实验数据,计算x 和y的比值(2分,写出计算过程;相对分子质量:NH3-17、BaSO4-233)
;
为进一步确定硫酸亚铁铵晶体的组成,另取7.84g硫酸亚铁铵晶体,并加热使其分解,剩余固体质量与温度的关系如图所示。则:

(11)根据图示数据,硫酸亚铁铵晶体中,
x:y:z = ;
(12)写出A点到B点发生反应的化学方
程式 。
化学兴趣小组的同学为了测定某赤铁矿石中氧化铁的质量分数。
Ⅰ.甲同学取一定质量的赤铁矿粉与过量的木炭粉混合后,用下图所示装置以合理的操作步骤测定(假设杂质始终不发生变化);反应生成单质铁和二氧化碳,以及少量的一氧化碳。
(1) 实验中持续通入干燥的氮气。加热前缓缓通入一段时间,其作用是 。
(2)反应结束后,甲同学熄灭了喷灯的火焰后,马上停止通入N2,他这样操作引起的后果
是 。
(3)如果b装置中氢氧化钠溶液对二氧化碳的吸收是完全的,那么甲同学用b装置中氢氧
化钠溶液的质量变化测定出氧化铁的质量分数将 (选填“偏大”、“偏小”
或“准确”)。
Ⅱ.乙同学取氧化铁的质量分数为80%的赤铁矿粉10g,加入足量稀盐酸,恰好完全反应,
共用去稀盐酸154.5g(假设杂质既不溶于水也不与酸发生反应)。
试计算反应后溶液中溶质的质量分数。(请写出计算过程)
下列实验方案设计合理的是
| 选项 |
实验目的 |
所用试剂(足量)或方法 |
| A |
除去一氧化碳中少量的二氧化碳 |
通过灼热的氧化铜 |
| B |
区别铁粉和四氧化三铁粉末 |
用磁铁吸引 |
| C |
分离氯化钠和氯化银的混合物 |
溶于水,过滤、洗涤,蒸发结晶 |
| D |
验证铝、铁、铜的金属活动性 |
稀盐酸 |
医用二水合氯化钙可用于补钙、抗过敏和消炎等,以某碳酸钙样品(其中含少量Al3+、Fe3+等杂质)生产医用二水合氯化钙的工艺流程为: (已知二水合氯化钙在温度超过160°C时分解为氯化钙和水)
已知:查阅资料得知氢氧化物沉淀及溶解时的pH为:
| 氢氧化物 |
Fe(OH)3 |
Al(OH)3 |
|
| 开始沉淀时的pH |
2.3 |
4.0 |
开始溶解:7.8 |
| 完全沉淀时的pH |
3.7 |
5.2 |
完全溶解:10.8 |
(1)在实验室进行溶解时玻璃棒的作用是 ,过滤时用到的玻璃仪器有烧杯、玻璃棒、 。
(2)除杂操作是加入稍过量的氢氧化钙,调节溶液的pH使Al3+、Fe3+全部转化为沉淀,此时应该控制溶液的的pH(X)范围是 ;滤渣A的主要成分的化学式为 。
(3)酸化时加盐酸的主要目的为了 。
(4)蒸发结晶时,必须控制温度低于160℃的原因是 。
(5)若所用碳酸钙样品12.5Kg,最后所得的产物中含氯化钙11.1Kg,则样品中碳酸钙的质量分数最大为多少 ?(写出计算过程,3分)
已知A—G均为初中化学常见的物质。其中A、B的组成元素相同,D是形成温室效应的主要原因,F中含有三种元素,E和G只有阳离子不同。根据图中所示的转化关系(图中“—”表示相互间能反应,“→”表示在一定条件下能生成该物质,反应条件均已略去),请回答: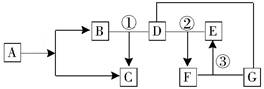
(1)C的化学式 、E中的阴离子符号是 、F的俗名为 ;
(2)反应①是自然界最常见的反应,我们称之为 ;反应②的化学方程式是 ;反应③的化学方程式是 ,该反应的基本类型是 反应,反应后过滤,把所得沉淀洗涤、干燥、称量,即可计算反应时消耗的F物质的质量。如果实验过程中没有洗涤,则计算所得F的质量 (填“偏大”或“偏小”或“不变”)。
(10分)某兴趣小组分别向80.00 g 10%的NaOH溶液中加入体积不同、质量分数相同的盐酸,充分反应后,将所得溶液加热蒸发,直到固体完全析出且没有任何变化后,再研细、烘干、称量;重复将固体烘干、称量,直至称得的固体质量不再发生变化。实验测得,向80.00 g10%的NaOH溶液中加入80.00 mL盐酸时,溶液恰好呈中性,其它测得的部分数据则如下表所示:
(1)加热蒸发所得溶液时需要用玻璃棒不断搅拌,其目的是: ;
(2)向80.00 g 10%NaOH溶液中加入盐酸的体积为100.00 mL时,最后所得固体的质量仍为11.70 g,其原因是: ,
(3)列式求出向80.00 g 10%NaOH溶液中加入40.00 mL盐酸时,最后所得固体中NaCl的质量分数(小数点后保留两位)。
试题篮
()