(10徐州20)把铝箔放入CuCl2溶液中,铝箔表面覆盖了红色物质,一会儿又有大量气泡冒出。同学们对“放出气体”这一异常现象进行猜想、实验。其中没有价值的是
| A.小宇同学推测气体是氢气并检验 |
| B.小琪同学猜想CuCl2溶液呈酸性并测定 |
| C.小寒同学认为气体是氨气并检验 |
| D.小梁同学认为试剂变质,更换后再实验 |
下列有关化学实验的“目的→操作→现象→结论”的描述都正确的是
| 选项 |
目的 |
操作 |
现象 |
结论 |
| A |
比较铝和铜的金属活动性 |
将砂纸打磨过的铝丝 浸入到硫酸铜溶液中 |
铝丝表面有红色固体析出 |
铝比铜活泼 |
| B |
检验露置在空气中的氢氧化钠溶液是否变质 |
取氢氧化钠溶液,滴入稀盐酸 |
开始时没有观察到气泡产生 |
氢氧化钠溶液没有变质 |
| C |
探究物质溶解于 水时的热量变化 |
向一定量水中加入硝酸铵晶体,充分搅拌 |
溶液温度下降 |
盐类物质溶解于水时,都会吸热 |
| D |
检验集气瓶中是否集满二氧化碳 |
将燃着的木条伸入集 气瓶中 |
木条火焰熄灭 |
集气瓶中已集满 二氧化碳 |
溶液的浓度可用溶质的质量占全部溶液质量的百分率来表示,叫质量百分浓度,用符号%表示。例如,25%的葡萄糖注射液就是指100克注射液中含葡萄糖25克。
下表是研究性学习小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10mL H2O2水溶液制取150mL氧气所需的时间(秒)
关于上述实验有下列几种说法,其中说法正确的是
①催化剂加快了反应速率
②浓度不是影响反应速率的因素
③此实验研究了四个影响反应速率的因素
④浓度越小,反应速率越慢
⑤浓度越大,反应速率越慢
| A.①④ | B.①② | C.①③⑤ | D.①③④ |
下列实验设计能达到实验目的的是
| 选项 |
A |
B |
C |
D |
| 实 验 设 计 |
 |
 |
 |
 |
| 实验目的 |
验证二氧化碳与水反应生成碳酸 |
确定石蜡成分中含有碳元素 |
探究可燃物燃烧需要氧气和温度达到着火点 |
证明铁生锈是水和氧气共同作用的结果 |
为了探究影响锌与盐酸反应剧烈程度的因素,某学习小组设计了下列实验
下列说法正确的是
| A.对比实验①和②,可研究盐酸的浓度对反应剧烈程度的影响 |
| B.对比实验②和③,可研究盐酸的浓度对反应剧烈程度的影响 |
| C.对比实验②和③,可研究温度对反应剧烈程度的影响 |
| D.对比实验①和②,可研究温度对反应剧烈程度的影响 |
下列是某化学学习小组在“人吸入的空气和呼出的气体中有什么不同”的探究活动中提出的一些说法,其中错误的是( )
| A.证明呼出的气体含二氧化碳多的证据是:呼出的气体能使澄清石灰水变浑浊 |
| B.判断呼出的气体含氮气的依据是:空气中含有氮气,而氮气不为人体吸收 |
| C.证明呼出的气体含水蒸气多的证据是:呼出的气体在玻璃片上结下水珠 |
| D.证明呼出的气体含氧气的证据是:呼出的气体能使木条燃烧更旺 |
碳酸氢钠(NaHCO3)是发酵粉的主要成分,常用于制作糕点、馒头的发泡剂。某同学为探究发酵粉样品中NaHCO3的质量分数,他取样品20.0g,进行如图实验探究:

假设样品中除NaHCO3之外的其他成分加热不发生变化,也不与盐酸反应,直接进入固体B中。下列判断正确的是( )
A.加热产生CO2的质量为3.1g
B.固体A中含有Na2CO3的质量为7.5g
C.蒸发结晶得到的固体B中含有剩余的HCl
D.原发酵粉样品中的NaHCO3的质量分数为84.0%
FeCl3溶液腐蚀铜、铁的反应分别为:Cu+2FeCl3=2FeCl2+CuCl2、Fe+2FeCl3=3FeCl2。
从腐蚀过镀铜器件的废液中回收铜,并重新制得FeCl3的流程如下: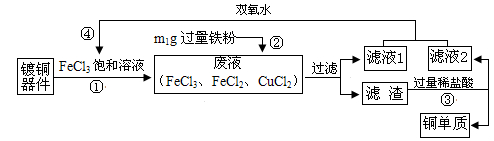
下列说法不正确的是
| A.步骤②中发生化合反应与置换反应 |
| B.“滤液1”中一定含FeCl2,可能含CuCl2 |
| C.步骤④反应为:2M+2FeCl2+ H2O2=2FeCl3+2H2O,M是HCl |
| D.若滤渣也为m1g,则废液中FeCl3与CuCl2的质量比为65∶54 |
除去下列物质中混有的杂质,所选用的试剂及操作方法均正确的是
| |
物质 |
杂质 |
除杂质应选用的试剂和操作方法 |
| A |
CO2 |
CO |
通入O2点燃 |
| B |
NaOH固体 |
Na2CO3固体 |
加入过量盐酸,蒸发 |
| C |
Cu(NO3)2溶液 |
AgNO3溶液 |
加入过量的铜粉,过滤 |
| D |
KCl溶液 |
KOH溶液 |
加入过量的CuCl2溶液,过滤 |
新型材料纳米级Fe粉在空气中易自燃,它能用作高效催化剂。实验室采用还原法制备纳米级Fe粉,其流程如图所示:
下列说法错误的是
| A.将FeCl2﹒nH2O加热脱水干燥的原因可能是生成的纳米级铁粉会与水反应。 |
B.Ⅱ中反应的化学方程式为 H2+FeCl2 Fe+2HCl Fe+2HCl |
| C.纳米级Fe粉比普通 Fe粉更易与氧气反应 |
| D.实验中通入的N2只起到防止纳米级铁粉自燃的作用 |
为了探究影响锌与盐酸反应剧烈程度的因素,某学习小组设计了下列实验(已知锌的颗粒大小相同,稀盐酸的温度均为室温)。下列说法正确的是
| A.对比实验①和②,可研究盐酸的浓度对反应剧烈程度的影响 |
| B.对比实验①和②,可研究温度对反应剧烈程度的影响 |
| C.对比实验②和③,可研究温度对反应剧烈程度的影响 |
| D.对比实验①和③,可研究盐酸的浓度对反应剧烈程度的影响 |
除去下列物质中的少量杂质所选用的试剂或方法正确的是
| 选项 |
物质 |
所含杂质 |
所选用试剂或方法 |
| A |
NaOH溶液 |
Na2CO3溶液 |
稀盐酸 |
| B |
CaO |
CaCO3 |
高温灼烧 |
| C |
CO2 |
CO |
点燃 |
| D |
稀盐酸 |
稀硫酸 |
加适量Ba(NO3)2溶液,再过滤 |
某兴趣小组设计了探究Zn、Cu、Ag三种金属活动性顺序的四组方案,你认为不可行的是
| A.在两支试管中各装少许ZnSO4溶液,分别加入铜片和银片 |
| B.在两支试管中各装少许CuSO4溶液,分别加入锌片和银片 |
| C.向盛稀盐酸的两支试管中,分别加入锌片和铜片,再向盛AgNO3溶液的试管中,加入铜片 |
| D.向盛有ZnSO4溶液和AgNO3溶液的两支试管里分别加入铜片 |
下列装置或操作能达到实验目的的是

A B C D
| A. | 稀释浓硫酸 |
| B. | 探究燃烧的三个条件 |
| C. | 测定空气中氧气的含量 |
| D. | 探究 的性质 |
为了探究影响锌与盐酸反应剧烈程度的因素,某学习小组设计了下列实验
下列说法正确的是( )
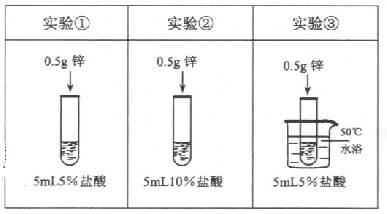
| A. | 对比实验①和②,可研究盐酸的浓度对反应剧烈程度的影响 |
| B. | 对比实验②和③,可研究盐酸的浓度对反应剧烈程度的影响 |
| C. | 对比实验②和③,可研究温度对反应剧烈程度的影响 |
| D. | 对比实验①和②,可研究温度对反应剧烈程度的影响 |
试题篮
()