小军同学在学习酸碱盐有关知识时,对一些沉淀物质的颜色产生了兴趣。老师告诉他氢氧化铜是蓝色、氢氧化铁是红褐色,让他自己探究氢氧化亚铁的颜色。下面请你和他一起探究。
[查阅资料]
(1)铁有两种氢氧化物,它们可以分别由相对应的可溶性盐与碱溶液反应而制得。
(2)氢氧化亚铁在空气中立即被氧化。
(3)硫酸铜溶液是蓝色,硫酸亚铁溶液是浅绿色。
[提出猜想]
氢氧化亚铁是浅绿色。
[实验过程]
在2支试管里分别加入少量FeCl3和FeSO4溶液,然后滴入NaOH溶液,观察现象。请补充完成下表:
| |
FeCl3溶液 |
FeSO4溶液 |
| 滴入NaOH溶液的现象 |
生成红褐色沉淀 |
先生成白色絮状沉淀,迅速变成灰绿色,最后变成红褐色沉淀。 |
| 化学方程式 |
基本反应类型属于 反应。 |
FeSO4+2NaOH = Fe(OH)2↓+Na2SO4 Fe(OH)2 + + H2O = (完成并配平此方程) |
[学习交流]
(1)氢氧化亚铁是 色而不是浅绿色。
(2)小军联系到CO2与C的反应,认为FeCl3溶液可以转化为FeCl2溶液。你认为小军的理由是
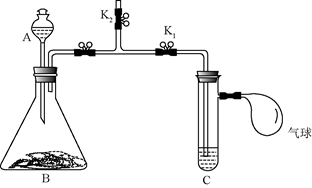
实验1:
步骤1:在
中加入少量白磷并加入热水,塞好胶塞使导管口进入热水中发现白磷不燃烧;
步骤2:打开
,关闭
,将
中的溶液滴入
中,
中有气泡冒出,白磷燃烧,
中发生的化学方程式为.通过以上实验研究了燃烧的一个条件。它是.
实验2:研究
与
固体的反应
步骤1:
中盛有稀盐酸、
中
固体,
中
固体打开
,关闭
,将
中溶液滴入
中,气球变大,打开
,关闭
,一段时间后气球没有明显变瘪。
步骤2:依据以上实验现象,改进后重新添加药品,进行实验2.
步骤3:打开
,关闭
,将
中液体滴入
中,用燃着的木条放在
上,发现木条熄灭,问上述操作的目的。然后进行后续实验,说明
与
固体发生了反应,后续实验的操作与现象为。
某同学为验证炭在氧气中不完全燃烧的产物既有
又有
,设计如图所示流程进行实验,根据所学知识回答相关问题.

(1)按上面连接好装置,在装入药品之前,必须进行的操作是;
(2)B装置中
浓溶液的作用是;
(3)实验开始时,必须先通入混合气体一段时间再点燃酒精喷灯加热,目的是;
(4)根据设计意图,观察到(填写实验现象)时,证明混合气体中既有
又有
;
(5)从环保角度分析,该流程设计中的一处明显不足是.
(1)为测定空气中氧气的含量,小华同学设计了如图15甲所示的实验方案:在一个隔热效果良好的容器上方安装一个可自由上下移动的活塞(活塞质量忽略不计,起始位置在5刻度处)。加热容器,使白磷燃烧。待反应完全,容器冷却至室温后,活塞最后停在刻度 处。有位同学用木炭取代白磷来进行实验,结果实验失败,请你分析实验失败的原因是 。
(2)为证明CO2能与NaOH溶液反应,小明同学设计了如图15乙所示的实验方案:从左端导管处通入CO2气体,若观察到____________________________的现象,证明CO2与NaOH溶液发生了反应。小军同学认为也可通过向CO2与NaOH溶液反应的生成物中加入一种试剂的方法来证明,他加入的这种试剂可能是____________。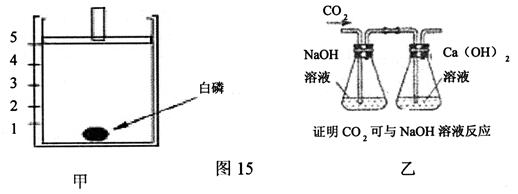
我市正在积极打造"海盐文化之都".食盐是生活必需品,也是重要的化工原料.
(1)某学习小组进行粗盐提纯实验,主要经过以下操作步骤:称量→溶解→→蒸发→再次称量→计算产率.在蒸发操作中使用到玻璃棒,作用是.实验结束后,该小组发现所得食盐产率明显低于其他小组,其原因可能是.
A.粗盐未充分溶解就过滤
B.倾倒时,有部分氯化钠溶液溅出
C.蒸发后,所得的精盐较潮湿
(2)电解饱和食盐水可以得到多种化工产品,主要过程如下:

①气体A是密度最小的气体,该气体的名称为,写出一个由酸
转化为气体
的化学方程式,该反应是(填"放热"或"吸热")反应.
②电解后生成的碱
的化学式为,你猜想的依据是.
为了检验草酸(H2C2O4)分解的产物中含一氧化碳、二氧化碳和水,并收集一氧化碳,设计了如下图所示的实验,按要求回答相应的问题:
【资料】CO遇到浸有磷钼酸溶液的氯化钯黄色试纸,立即变蓝;而CO2遇该试纸不变色
(1)当D中出现浑浊现象时可证明产物中含有二氧化碳,D中盛放的是 ,可证明产物中还含有一氧化碳和水的实验现象是 。
(2)E装置的作用是 ,则E中的溶液是 ,发生反应的化学方程式是 。
下列有三种制取硝酸铜的方案:
方案一:Cu + 4HNO3(浓) = Cu(NO3) + 2NO2↑+ 2H2O
方案二:3Cu + 8HNO3(稀) = 3Cu(NO3) + 2NO↑+ 4H2O
方案三:2Cu + O2 + 4HNO3(稀)= 2Cu(NO3)2 + 2H2O
请你从经济、环保的角度分析考虑选择一种最适宜的方案 ,你选择方案而不选其它方案的理由是(写两点):
。
隔夜莱是否能吃,主要在于烧熟后的隔夜菜中亚硝酸盐含量的变化是否符合食品安全要求。蔬菜中的硝酸盐来自生长过程中所施氮肥。空气中的微生物(如硝酸盐还原菌)进入到蔬菜中,会产生一种还原酶,使蔬莱中的部分硝酸盐还原成亚硝酸盐。烧熟后的莱在食用和保存阶段都会有一些细菌进入;做熟的蔬菜更适合细菌生长。某研究小组对烧熟的莱中亚硝酸盐含量做了测试,数据如下表:
| 菜肴 |
半小时 |
6小时 |
18小时 |
24小时 |
| 炒青菜 |
0.6861 |
0.7982 |
4.3333 |
55.3624 |
| 韭菜炒蛋 |
1.8153 |
1.9249 |
2.8390 |
5.6306 |
| 红烧肉 |
2.4956 |
4.2558 |
4.3668 |
5.5188 |
| 红烧鲫鱼 |
2.0948 |
3.2300 |
7.2397 |
盖有保鲜膜的菜肴在
的冰箱中放置不同时间的亚硝酸盐含量(单位:
)将一份红烧鲫鱼样本(不盖保鲜膜)在常温下放置4小时,测定其亚硝酸盐含量为8.9483
。请根据以上材料,回答下列问题:
(1)亚硝酸盐中含有
,其中氮元素的化合价是价;
(2)根据表中的数据,莱中的亚硝酸盐含量变化的共同规律是;
(3)要使烧熟后的隔夜莱中亚硝酸盐含量尽可能低,保存的条件应该是;
(4)炒菜过程中温度一般在100
以上,你认为从生莱炒到熟菜过程中的亚硝酸盐含量是否会持续增加,原因是。
铜跟浓硫酸的反应原理是: ↑。某小组同学用下图所示装置制取硫酸铜。请回答以下问题:

(1)图中
装置用来收集
(已知
的密度大于
的密度),但未将导管画全,请在答题纸上将
装置中的导管补画完整。
(2)图中
装置的作用是防止氢氧化钠溶液倒吸入
瓶中,装置
的作用是.
(3)充分反应后,烧瓶中的铜片仍有剩余,那么硫酸是否也有剩余呢?该小组同学进一步研究:待烧瓶冷却后,将烧瓶中的混合物稀释、过滤,用滤液做了如下实验。
实验1:用
试纸测试滤液
,其
约为1;
实验2:取少量滤液于试管中,向试管中滴加氯化钡溶液,有白色沉淀现象。
你认为,可说明硫酸有剩余。(选填"实验1"或"实验2")
(4)以铜片与浓硫酸为原料用上述方法制取硫酸铜,存在的缺陷有(答出两点即可。)
有三种白色粉末,分别是碳酸钡、硫酸钡和碳酸钠。请设计一个实验方案把这三种粉末区分开来。叙述实验操作、预期现象和结论。(实验室仅提供了稀盐酸、Na2SO4溶液、蒸馏水以及常用的实验仪器)
| 实验操作 |
预期现象与结论 |
| |
|
| |
|
氮化镁是一种应用范围非常广泛的无机化合物,它可用于制备高硬度、高热导、抗腐蚀、抗磨损和耐高温的其它元素的氮化物,制备特殊的陶瓷材料等。某校化学研究小组用镁与氮气反应制备氮化镁(Mg3N2),并用实验方法测定氮化镁的纯度。
I.制备氮化镁
【查阅资料】
①(NH4)2SO4+2NaNO2 2N2↑+Na2SO4+4H2O,该反应为放热反应。
2N2↑+Na2SO4+4H2O,该反应为放热反应。
②饱和硫酸亚铁溶液能吸收氧气;稀硫酸能吸收氨气。
③在常温下或温度不高的条件下镁几乎与水不反应。
【实验】
制备氮化镁的装置示意图如下:
(1)D装置的作用是 ,G装置的作用是 。
(2)E装置中发生反应的化学方程式为 。
(3)实验时先进行 (选填“A”或“E”)处加热,理由是 。
II.测定氮化镁的含量
氮化镁是浅黄色粉末,极易与水反应生成Mg(OH)2沉淀和NH3,反应的化学方程式为 ,氮化镁(Mg3N2)中氮元素的化合价是 。
【定性分析】
步骤一:取少量氮化镁样品于试管中,加足量蒸馏水,试管底部有沉淀生成,试管口闻到有刺激性气味的气体生成。
步骤二:弃去上层清液,加入稀盐酸,观察到沉淀全溶且冒气泡。该步骤中产生气泡的化学方程式为 。
【定量测定】
按下图实验装置进行实验:
(4)取氮化镁样品16g进行实验,I装置增重3.4g,求该样品中氮化镁的质量分数(请写出计算过程)。
(5)球形干燥管的作用是 。
某固体粉末由Mg、MgO和Mg(OH)2中的一种或几种组成。某化学小组为了探究该固体粉末的成分,设计如图所示的装置(固定装置省略)
[信息资料]本实验条件下,氢气密度为0.09g/L。
[实验过程]
步骤Ⅰ:检查装置气密性,装入药品并连接仪器。
步骤Ⅱ:倾斜Y形管,使样品充分反应,测定生成气体的体积为55.6mL。
步骤Ⅲ:拆下装置,往Y形管内残余液中加入氢氧化钠溶液,至不再生产沉淀。经过滤、洗涤和干燥后,称得沉淀质量为2.90g。
[回答问题]
(1)该套装置气密性的检查方法是 。
(2)①使样品与硫酸充分反应的正确操作是 (填标号)。
A.硫酸溶液转移到样品中 B.样品转移到硫酸溶液中
②判断样品完全反应的现象是 。
(3)根据实验结果分析:
①通过步骤Ⅱ推断,样品中一定含有的物质是 。
通过步骤Ⅲ计算,样品中镁元素的总质量为 g。
②结论:该样品中的成分是 。
[反思]
(4)该化学小组同学经过讨论得到以下结论,正确的有 (填标号)。
A.利用该实验方案,能计算出样品中各物质的质量
B.实验前可通过样品的质量估算硫酸溶液的质量,确保样品完全反应
C.仅称量步骤Ⅱ中Y形管内药品减轻的质量,即能计算出样品中各物质的质量。

在如图的装置中,当两种溶液发生反应后,天平不在保持平衡,指针向右偏转。天平不平衡的原因是,反应的化学方程式为。若反应物不变,要使天平在反应后仍然保持平衡,你认为对装置的改进措施是。

根据下图所示实验装置,回答问题。

|
|
(1)实验A中观察到的现象是 ,说明分子具有的性质是 。
(2)实验B中的现象是 ,此实验说明二氧化碳具有的性质是 。某补钙剂的主要成分是碳酸钙(其他成分不含钙元素且不与盐酸反应).化学活动小组想测定该补钙剂中钙元素的质量分数,设计方案如下(如图所示,图中固定装置的仪器已略去);检查装置气密性良好,取10片药片研细,加入足量稀盐酸充分反应,产生气体经干燥后通入氢氧化钠溶液中,根据实验数据计算钙元素的质量分数.
(1)装置D的作用是 ;
(2)为了获取所需数据,将以上方案补充完整.
(3)有同学认为:反应生成的二氧化碳中可能混有少量氯化氢气体,可以利用二氧化碳难溶于饱和碳酸氢钠溶液的性质除去氯化氢,你是否同意他的观点,说明理由.
(4)根据以上方案测定结果会偏低,分析原因并改进.
试题篮
()