某化学兴趣小组对CO2是否支持常见金属的燃烧进行探究活动。
【活动探究】探究CO2是否支持实验室常见金属镁的燃烧。
实验①:将燃着的镁条插入充满CO2的集气瓶,发现镁条仍燃烧。生成物除白色MgO外,还有一种黑色固体。
(1)镁在CO2中反应的化学方程式为 ,此反应的基本类型是 。
(2)实验①的结论是 。由该结论可知 (写“能”或“不能”)用CO2灭火器扑灭活泼金属的火灾。
(3)通过实验①你对燃烧条件的新认识是 。
小雨阅读课外资料得知:氯酸钾的分解可用二氧化锰、氧化铜等物
质作催化剂。于是,他对影响氯酸钾分解的因素及催化剂的催化效果产生了探究
兴趣。
【提出问题】氧化铜是否比二氧化锰催化效果更好?影响氯酸钾分解速率的因素有哪些呢?
【设计实验】小雨以生成等体积的氧气为标准,设计了下列几组实验。
| 序号 |
KClO3的质量 |
其他物质的质量 |
温度 |
氧气的体积 |
反应所需时间 |
|
| ① |
2.0g |
|
330℃ |
100mL |
t1 |
|
| ② |
2.0g |
CuO 0.5g |
330℃ |
100mL |
t2 |
|
| ③ |
2.0g |
MnO2 0.5g |
330℃ |
100mL |
t3 |
|
| ④ |
2.0g |
MnO2 g |
380℃ |
100mL |
t4 |
|
(1)若t1 t2(填“>”、“=”、“<”),说明氧化铜能加快氯酸钾的分解速率。若要确定氧化铜是此反应的催化剂,还需探究反应前后,氧化铜的________________和________________不变。
(2)你认为小雨设计实验③和实验②对比的目的是 。
(3)实验④中MnO2的质量为 g,若t3>t4,则化学反应快慢与温度的关系是 。
(4)写出实验④所涉及的化学方程式 。
某校化学兴趣小组的同学根据实验室提供的仪器和药品,在老师的指导下从下图中选择装置进行了氧气的制备实验。
(1)写出仪器a的名称: 。
(2)甲同学从上图中选择A、E装置的组合制取氧气,该反应的化学方程式为: .在用胶皮管连接装置A和E中的玻璃导管时,应先把玻璃管口 ,然后稍稍用力把玻璃管插入胶皮管。收集气体前,应将集气瓶装满 并盖上 。收集氧气还可选用的装置是 。
(3)乙同学称取一定质量的 固体放入大试管中,将温度控制在250℃加热制取
固体放入大试管中,将温度控制在250℃加热制取 。该反应的化学方程式为
。该反应的化学方程式为 。实验结束时,乙同学发现用排水法收集到的
。实验结束时,乙同学发现用排水法收集到的 大于理论产量。针对这一现象,同学们进行了如下探究:
大于理论产量。针对这一现象,同学们进行了如下探究:
[提出猜想]猜想I:反应生成的 分解放出
分解放出 ;
;
猜想II:反应生成的 分解放出
分解放出 ;
;
猜想III:反应生成的 和
和 分解都放出
分解都放出 。
。
[实验验证]同学们分成两组,分别进行下列实验:
第一组同学取一定质量的 ,在250℃条件下加热一段时间,冷却后测得
,在250℃条件下加热一段时间,冷却后测得 的质量不变,则猜想____错误;第二组同学取
的质量不变,则猜想____错误;第二组同学取 在250℃条件下加热,没有用测定质量的方法得出了猜想II正确的结论。该组同学选择简单的实验方法是 .
在250℃条件下加热,没有用测定质量的方法得出了猜想II正确的结论。该组同学选择简单的实验方法是 .
[拓展延伸]实验发现, 固体加热制取
固体加热制取 的反应速率很慢,但如果将KMnO4固体与
的反应速率很慢,但如果将KMnO4固体与 固体混合加热,则
固体混合加热,则 的分解速率大大加快。请说明
的分解速率大大加快。请说明 在
在 的分解反应中是否作催化剂 (选填“是”或“否”),为什么? .
的分解反应中是否作催化剂 (选填“是”或“否”),为什么? .
瑶瑶同学在实验室发现有一瓶没有标签的白色粉末,可能含有 、
、 、
、 和无水
和无水 中的一种或几种,为确定白色粉末的成分,取该白色粉末进行以下实验:
中的一种或几种,为确定白色粉末的成分,取该白色粉末进行以下实验:
【提出问题】这包白色粉末的成分是什么?
【实验探究1】瑶瑶同学取白色粉末少许于试管中,向其中加入足量的蒸馏水充分溶解后,得到无色透明溶液,瑶瑶同学所得能出的结论是_________ ;
【实验探究2】瑶瑶同学取上述所得无色透明溶液于另一试管中,向其中加入足量的稀盐酸,观察到_________ 的现象,得出结论,白色粉末中一定含有 ,推出一定不含
,推出一定不含 ,请写出上述反应的化学方程式是_________ .
,请写出上述反应的化学方程式是_________ .
【实验探究3】为了验证氯化钠是否存在,瑶瑶同学做了如下实验:取原粉末少许于试管中,加足量的蒸馏水充分溶解后,再向其中滴加_________ 和_________ ,后当观察到_________ 现象后,确定白色粉末中还含有氯化钠.
随着经济的发展,能源与环境成为人们日益关注的问题。
(1)煤、 和天然气常称为三大化石燃料。将煤作为燃料,主要是利用碳元素与氧气反应所放出的热量。碳与氧气反应的化学方程式为: 。
(2)化石燃料燃烧都会产生二氧化碳,会引起温室效应。为控制二氧化碳的排放量,可充分利用和开发的新能源有 (填1种即可)。
(3)低碳经济是以较少的温室气体排放获得较大产出的新经济发展模式。下列做法中符合“低碳经济”理念的是 (填字母序号)。
A.大力发展火力发电
B.改造或淘汰高能耗、高污染产业
C.优化建筑设计,增强室内自然采光,减少照明用电
D.出行尽量开私家车
E.夏季将制冷空调温度尽量调低
(4)在汽车尾气管上安装净化装置,可使尾气中的一氧化碳和一氧化氮气体在催化剂的表面发生反应,生成氮气和二氧化碳,该反应的化学方程式为 。
(5)某化学兴趣小组的同学对甲烷燃烧的产物产生了兴趣,请你参与:
【提出问题】甲烷燃烧后生成哪些物质?
【查阅资料】含碳元素物质完全燃烧生成CO2,不完全燃烧生成CO;无水CuSO4遇水变蓝。
【猜想与假设】甲 CO2 H2O ;乙 CO H2O; 丙 NH3 CO2 H2O; 丁 CO2 CO H2O 。
你认为 同学的猜想肯定错误,理由是 。
【实验探究】为了验证上述猜想,将甲烷在一定量的O2中燃烧的产物依次通过下列装置:
①实验中观察到A中无水CuSO4变蓝,B、D中澄清石灰水变浑浊,C中红色粉末变成了黑色,由此推断 同学猜想成立。
②请写出B、C中反应的化学方程式:
、 。
【反思与交流】:为避免有毒的CO污染环境,所以含碳元素的物质燃烧必须满足的条件是 。
(9分)随着社会的发展,人们对环境问题日益关注,同学们对煤进行了下列探究:
【提出问题】煤中是否含有碳元素和硫元素?
【查阅资料】①二氧化硫能使高锰酸钾溶液褪色(由紫红色变为无色),该反应化学方程式为: 5SO2 + 2KMnO4 + 2H2O ="=" K2SO4 + 2MnSO4 + 2H2SO4
②二氧化硫和二氧化碳一样,也能使澄清石灰水变浑浊,反应原理:
SO2 + Ca(OH)2 = CaSO3↓+ H2O。
【实验探究】
实验1:甲同学进行了如图所示A、B两步实验:

实验现象:A中稀高锰酸钾溶液褪色,B中澄清石灰水变浑浊。
甲得出结论:煤中含有碳元素和硫元素。
乙质疑甲同学的方案的合理性,其质疑的理由是____________________________________。
实验2:乙设计并进行了如图所示实验(夹持装置略去):

实验现象:①B中溶液褪色;②C中溶液变浅;③D中溶液变浑浊。
乙得出结论:煤中含有碳元素和硫元素。
【交流反思】(1)将煤磨成煤粉的目的是_________________________。
(2)实验中装置C的作用是________________________。
(3)D装置中发生反应的化学方程式为______________________。
(4)某工厂因生产需要每年要燃烧含硫0.8%的煤10000吨(假设煤中的硫为单质状态),利用方程式计算,若未经处理该工厂每年会向大气中排放的二氧化硫质量是多少?
世界上每年因锈蚀而报废的金属设备和材料,高达产量的20%~40%,某实验小组对铁的燃烧和锈蚀进行如下探究。
探究一:铁丝燃烧
如图1所示,取3根粗细、长度均相同的光亮细铁丝,将其中两根分别盘成螺旋状,在每根铁丝一端系上粗铜丝,另一端系一根火柴杆,点燃火柴杆待快燃尽时,分别插入充满氧气的集气瓶中。观察到:Ⅰ、Ⅱ中铁丝都剧烈燃烧,且Ⅱ中铁丝燃烧比Ⅰ中的更剧烈;Ⅲ中铁丝没有燃烧。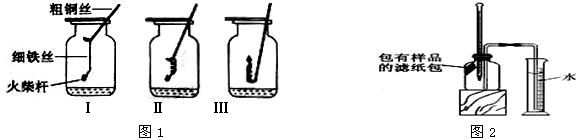
(1)集气瓶中加入少量水的作用: 。
(2)为什么Ⅲ中铁丝不能燃烧 。
(3)分析Ⅱ中铁丝燃烧比Ⅰ中更剧烈的原因 。
探究二:铁粉腐蚀的条件
如图2所示,将所有样品的滤纸包用大头针固定在橡胶塞上,迅速塞紧,观察到量筒内水沿着细导管慢慢进入广口瓶(容积为146 mL)。当温度恢复至室温,量筒内水面高度不变时读数(此时广口瓶内氧气含量几乎为零),记录量筒的起始和最终读数以及所需时间如下表:
| 序号 |
样 品 |
量筒起始读数/ mL |
量筒最终读数/ mL |
所需时间/ min |
| ① |
1.0g铁粉、0.2g碳和10滴水 |
100 |
72 |
约120 |
| ② |
1.0g铁粉、0.2g碳和10滴水和少量NaCl |
100 |
72 |
约70 |
| ③ |
|
|
|
|
(4)实验①和②说明NaCl可以 (填“加快”或“减慢”)铁锈蚀的过程。
(5)实验开始后,广口瓶温度上升,说明铁锈蚀是 (填“放热”或“吸热”)过程。
(6)实验①和③是探究碳对铁锈蚀速率的影响,实验③表格空白处样品的组成是 。
(7)该装置还可能用于测量空气中氧气的含量,根据上述数据计算得出空气中氧气的体积分数约是 %(精确到小数点后1位),试分析该实验结果出现误差的原因 。
某实验小组的同学在整理实验仪器时,发现了一个盛有黑色固体的烧杯。在请教老师后,同学们得知烧杯中的固体是加热制取氧气的剩余物(反应完全),从中可以回收得到MnO2。小组同学将黑色固体取出,并对其进行了探究。
【查阅资料】
①实验室中可以加热二氧化锰和氯酸钾(KClO3)固体的混合物制取氧气,同时生成氯化钾。
②氯化钾溶于水,其水溶液呈无色;锰酸钾溶于水,其水溶液呈绿色。
Ⅰ.探究黑色固体是哪个化学反应的剩余物。
【猜想】猜想一:H2O2制取氧气;猜想二:KClO3制取氧气;猜想三: 。
根据所学知识判断,猜想一不成立,理由是_________________。
【进行实验】
取少量黑色固体于另一个烧杯中,加入足量蒸馏水溶解,振荡,过滤后得到黑色滤渣和无色滤液。
【得出结论】猜想 成立,理由是 。
Ⅱ.探究二氧化锰在氯酸钾固体加热制取氧气反应中的作用。
【猜想】猜想一:是反应物; 猜想二:是催化剂。
【进行实验】
| 实验操作 |
实验现象 |
| 1、取12.25g氯酸钾在试管中加热,把带火星的木条伸入试管。 |
固体融化,产生少量气体,木条上的火星变亮。 |
| 2、取12.25g氯酸钾和2.55g二氧化锰混合均匀后在试管中加热,把带火星的木条伸入试管。 |
_______________。 |
| 3、待反应完全后,将试管中的剩余物加足量的水溶解,过滤,并将全部滤渣洗涤、干燥、称量。 |
称量固体的质量是_____g |
【实验结论】猜想二成立,二氧化锰在氯酸钾固体加热制取氧气的反应中起到催化作用。
【反思与交流】
小贝同学提出,前面的实验不足以证明二氧化锰在这个反应中起到了催化作用,因为①。
经过讨论,大家设计了一个补充实验,证明了猜想二成立,请你写出实验操作②。
“滴水生火”魔术:向包有淡黄色过氧化钠(Na2O2)粉末的脱脂棉上滴加水,脱脂棉随即燃烧。某同学对该“魔术”很感兴趣,设计实验进行探究。
【提出问题】过氧化钠与水反应生成什么物质? 脱脂棉为什么会燃烧?
【实验1】取一支干燥的大试管,加入少量过氧化钠粉末,滴加蒸馏水,观察到试管内发生剧烈反应,产生大量气泡,用手触摸,试管底部发烫。
【提出猜想】生成的气体产物可能是:① ;② 。
【实验2】为探究气体产物,进一步设计并完成如下实验。
请完成表中空格:
| 操 作 |
现 象 |
结 论 |
| 将带火星的木条伸入试管 |
带火星的木条复燃 |
气体产物是 |
【查阅资料】脱脂棉是经过化学处理去掉脂肪的棉花,极易燃烧;过氧化钠与二氧化碳反应生成碳酸钠和氧气。
【实验结论】
①过氧化钠与水的反应是 反应(填“吸热”或“放热”)。
②脱脂棉燃烧的原因 。
③扑灭由过氧化钠引发的火灾时,可以选择的灭火材料是 。
A.二氧化碳 B.水 C.沙子
如图所示,某兴趣小组在进行酸碱中和反应的实验探究时,向烧杯中氢氧化钠溶液中滴加稀盐酸一会儿后,发现忘记滴加指示剂。甲同学从烧杯中取少量反应后的溶液于一支试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到酚酞试液不变色。

(1)请写出该中和反应方程式: 。
猜想与假设:
【猜想一】甲同学:“两种物质已恰好完全中和,溶液呈中性”;
【猜想二】乙同学:“反应后氢氧化钠过量,溶液呈碱性”;
【猜想三】丙同学: 。
甲、丙两位同学经过讨论后觉得乙同学的猜想不正确,两位同学的理由是: 。
(2)设计并进行实验:
①为了验证自己的猜想,甲同学设计了以下实验方案:
| 实验步骤 |
实验现象 |
实验结论 |
| 用洁净干燥的玻璃棒蘸取少量反应后的溶液滴在干燥的pH试纸上,观察颜色变化并与标准比色卡对比。 |
pH_______(填“>”、“=”或“<”)7 |
猜想一不成立 |
②请你设计另一个实验(与甲同学方案不同)方案,验证丙同学的猜想,并填写下表:
| 实验步骤 |
实验现象 |
实验结论 |
| |
|
猜想三: ______________ (填“成立”或“不成立”) |
(一)小明和小亮同学在实验室帮老师配制石灰水时,将两药匙熟石灰样品放入小烧杯中,向其中加入一定量的蒸馏水,充分搅拌后发现烧杯底部仍有不溶性的固体,于是小明认为熟石灰样品已经变质。小亮同学不同意他的判断,你认为小亮同学的理由 。同学们针对该熟石灰样品的成分展开了讨论,请你参与讨论并完成实验报告。
【提出问题】熟石灰样品的主要成分是什么?
【作出猜想】甲同学猜想是Ca(OH)2;
乙同学猜想是CaCO3
你认为是 。
【实验与结论】请你通过实验验证你的猜想:
| 实验步骤 |
实验现象 |
实验结论 |
| 取少量的熟石灰样品于烧杯中,加适量的水充分溶解后过滤。 向滤液中加入适量的 溶液; |
; |
乙的猜想不正确 |
| 向滤出固体中加入适量 溶液。 |
。 |
你的猜想正确 |
【拓展与应用】小组同学反思了熟石灰变质的原因,认识到实验室应 保存熟石灰。
(二)在做盐跟盐反应的分组实验时,第一组学生进行BaCl2与Na2CO3溶液的反应,第二组学生进行BaCl2与Na2SO4溶液的反应。实验结束后,两组同学将全部的浊液集中倒进一个废液缸中。浊液中白色沉淀物质
是 和 。(填物质的化学式)
化学兴趣小组对浊液进行过滤,探究滤液的成分。
【提出问题】滤液里除了NaCl外,还有什么物质?
【提出猜想】猜想①: ;
猜想②:Na2SO4;
猜想③:Na2CO3;
猜想④:Na2CO3、Na2SO4
【实验探究】
若现象a只有气泡产生,则猜想 可能成立;若现象b产生白色沉淀,然后加稀硝酸沉淀部分溶解,若沉淀全部不溶解,则猜想 成立。
实验室中有甲、乙两瓶过氧化氢溶液,均标有“10%”字样。相同条件下,用这两瓶过氧化氢溶液制取150mL氧气,所用时间明显不同。对此,同学们进行如下探究。
【猜想】两瓶过氧化氢溶液中溶质的质量分数不同
【进行实验】
| 序号 |
实验装置 |
主要实验步骤 |
实验现象 |
| 实 验 1 |
 |
向两支试管中分别加入等量的甲、乙两瓶中的过氧化氢溶液,对比观察 |
两支试管中均有细微的气泡产生 |
| 实 验 2 |
 |
将两个相同的蜡烛分别点燃后放入两个烧杯中,然后分别向两个烧杯中加入等量的甲、乙两瓶中的过氧化氢溶液,再向过氧化氢溶液中加入等量的二氧化锰固体 |
两烧杯内液体中均产生气泡、有白雾,两烧杯内蜡烛均继续燃烧,但加入甲瓶溶液的烧杯中,蜡烛燃烧得更明亮 |
| 实 验 3 |
 |
向装有等量二氧化锰的两个锥形瓶中分别加入等量的甲、乙两瓶中的过氧化氢溶液 |
两锥形瓶内液体中均产生气泡、有白雾,同时有现象①出现 |
【实验结论】
甲瓶溶液中溶质的质量分数大于乙瓶溶液中溶质的质量分数。
【分析与解释】
(1)实验2和实验3中,均发生反应的化学方程式为 。
(2)实验2中,影响蜡烛燃烧明亮程度的因素是 。
(3)实验3中,现象①为 。
【反思与评价】
(1)实验1未观察到现象明显不同的主要原因是________。
(2)实验2和实验3分别应用了化学科学研究中两种重要的方法,它们是_____和_____。
(3)通过以上实验得到如下启示:影响反应速率的因素有 ;欲使燃着的物质燃烧更旺,可采用的方法是 。
研究性学习小组选择“H2O2生成O2的快慢与什么因素有关”的课题进行探究,以下是他们探究的主要过程:
【假设】 H2O2生成O2的快慢与催化剂种类有关
【实验方案】常温下,在两瓶相同体积的H2O2溶液中分别加入相同质量MnO2和红砖粉,测量各生成一瓶(相同体积)O2所需要的时间。
【进行实验】右下图是他们进行实验的装置图,此实验中B处宜采用的气体收集方法是: __________________。
【实验记录】
| 实验编号 |
1 |
2 |
| 反应物 |
6% H2O2 |
6% H2O2 |
| 催化剂 |
1g 红砖粉 |
1g MnO2 |
| 时间 |
152 s |
35 s |
【结论】该探究过程得出的结论是_______________________________________________。
【反思】H2O2在常温下分解缓慢,加入MnO2或红砖粉后反应明显加快,若要证明MnO2和红砖粉是该反应的催化剂,还需要增加实验来验证它们在化学反应前后的_____________和_____________是否改变。
我们通过对“吸入的空气和呼出的气体有什么不同”的实验探究,可得出的结论是
(1)人体吸入的空气比呼出的气体所含的氧气______________________;
(2)人体吸入的空气比呼出的气体所含的二氧化碳_______________;
(3)人体吸入的空气比呼出的气体所含水蒸气___________________。
常温下没有氧气存在时,铁与水几乎不反应,但高温下,铁与水蒸气能反应生成一种常见铁的氧化物和一种气体。小明很好奇,设计如下实验探究铁粉与水蒸气反应后的产物。
(1)试管尾部放一团湿棉花的目的是_______________。
(2)探究生成的气体是什么?
用燃着的木条靠近肥皂泡,有爆鸣声,稍后有肥皂泡飘到空中。说明生成的气体是______________。
(3)探究试管中剩余固体成分是什么?
【查阅资料】(1)金属氧化物能和酸反应且生成物能溶于水 (2)信息如表格
| 常见铁的氧化物 |
FeO |
Fe2O3 |
Fe3O4 |
| 颜色、状态 |
黑色粉末 |
红棕色粉末 |
黑色晶体 |
| 能否被磁铁吸引 |
否 |
否 |
能 |
【初步验证】试管中剩余固体为黑色,能全部被磁铁吸引。
【猜想与假设】猜想一:剩余固体是Fe与Fe3O4;猜想二:剩余固体是_____________。
【实验探究】
| 实验操作 |
实验现象 |
结论 |
| |
|
猜想二正确 |
【实验结论】铁和水蒸气反应的化学方程式为___________________________________.
【反思与交流】该黑色固体不可能是Fe2O3,理由是_______________________________.
试题篮
()