根据图中A,B.C三种固体的溶解度曲线回答:
(1)t1℃时,A的不饱和溶液变成饱和溶液可采用的一种方法是 ;
(2)t2℃时,A,B,C三种物质的溶解度大小关系是 ;
(3)将t2℃的A,B,C三种物质的饱和溶液降温到t1℃,不会析出晶体的是 。

酸、碱、盐是重要的化合物,研究它们的性质有重要意义.
(1)NaCl、KNO3、NH4Cl三种固体在水中的溶解度曲线如图所示,请仔细观察曲线,回答下列问题:
①三种固体物质的溶解度受温度影响最小的是 .
②30℃时三种固体物质饱和水溶液中溶质的质量分数由大到小的顺序是 .
③图中A、B点的坐标为:A(10,21)、B(40,64).若将100g40℃的硝酸钾饱和水溶液降温到10℃,析出KNO3固体的质量为 g(保留一位小数).
(2)实验桌上有NaOH、Ba(OH)2、Na2CO3、稀硫酸四种溶液,它们只有编号却没有标签.某同学按下列步骤鉴别四种溶液.

①写出反应Ⅲ的化学方程式 .
②如图是水和NaOH水溶液中微粒的存在情况示意图,由此分析C溶液能使酚酞溶液变红的原因是 (填序号).

a.C溶液中Na+数目大于CO32﹣数目
b.C溶液中H2O数目大于OH﹣数目
c.C溶液中H2O数目大于H+数目
d.C溶液中OH﹣数目大于H+数目.

如图是甲、乙两种固体物质的溶解度曲线。请回答:
(1)图中P点表示甲的溶液是 (填“饱和”或“不饱和”)的。
(2)要将t3℃时乙的饱和溶液变为不饱和溶液,可采用的方法是 (填一种即可)。
(3)将t2℃甲的饱和溶液降温至t1℃时,所得溶液的溶质质量分数 (填“变大”,“变小”或“不变”)。

如图1是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线。回答下列问题:

(1)t1℃时,甲、乙、丙三种物质的溶解度由大到小的顺序是 。
(2)P点表示,t2℃时,甲、丙两种物质的饱和溶液中,溶质与溶剂的质量比相等,均为 。
(3)t2℃时,取甲、乙两种固体各15g分别加入40g水中充分溶解,实验现象如图2所示,则烧杯a中溶解的物质是 (填“甲”或“乙”),所得溶液的质量为 g。
(4)当甲中含有少量的乙和丙(甲、乙、丙相互间均不发生化学反应)时,可采用 (填“降温”或“蒸发”)结晶的方法提纯甲物质。
(5)下列说法正确的是 (填字母序号)。
A.将甲物质的溶液由t3℃降温到t2℃,一定有晶体析出
B.将甲物质的饱和溶液由t2℃升温至t3℃时,其溶质质量分数增大
C.将t3℃时三种物质的饱和溶液恒温蒸发等质量的水,析出溶质的质量:甲>乙>丙
D.将t3℃三种物质的饱和溶液降温至t2℃,所得溶液的溶质质量分数:乙>甲=丙
化学是造福人类的科学,请利用所学知识回答下列问题。
(1)新型材料有着广泛的应用。
应用 |
“蛟龙”号深潜器 |
“神舟”五号宇航员航天服 |
新型水处理剂 |
用到的材料 |
特种钢 |
高强度涤纶 |
纳米铁粉 |
①上述材料中属于有机合成材料的是 。
②纳米铁粉能吸附废水中的某些污染物,被吸附后的废水经沉降、过滤可去除污染物。
下列物质也能因吸附而具有净水作用的是 (填字母)
a.生石灰 b.活性炭 c.纯碱
(2)溶液与人们的生产生活密切相关,图I为甲、乙、丙三种固体物质的溶解度曲线。
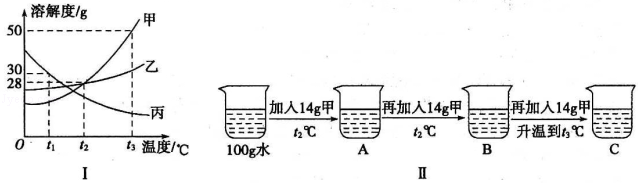
①t1℃时甲、乙、丙三种物质的溶解度由大到小的顺序是 。
②某同学按图Ⅱ所示进行实验,得到相应温度下的A、B、C三种溶液,其中属于饱和溶液的是 (填字母)。
③t3℃时向盛有40g甲物质的烧杯中加入50g水充分溶解后,所得溶液溶质的质量分数为 。(结果精确到0.1%)
硝酸钾、氯化钾的溶解度曲线如图1所示。
(1)P点的含义是 。
(2)当温度 时,氯化钾的溶解度大于硝酸钾的溶解度。
(3)t2℃时,分别将30g硝酸钾和氯化钾加入到50g水中,充分溶解后一定形成饱和溶液的是 ,其溶液的溶质质量分数为 (结果精确到0.1%)。
(4)图2是有关硝酸钾溶液的实验操作及变化情况。若保持溶液的质量不变,操作Ⅰ为 。
(5)下列有关说法不正确的是 。
A.①与②的溶质质量可能相等
B.②与③的溶质质量分数一定相等
C.等温度、等质量的硝酸钾和氯化钾饱和溶液,恒温蒸发等质量的水,析出的晶体质量:硝酸钾>氯化钾
D.等温度、等质量的硝酸钾和氯化钾饱和溶液,降低相同的温度,析出的晶体质量:硝酸钾>氯化钾
甲、乙、丙三种物质的溶解度曲线如图所示。
(1)t1℃时,甲、乙、丙三种物质的溶解度由大到小顺序为 ;
(2)t2℃时,乙物质的溶解度为 g
(3)将t2℃时180g甲的饱和溶液降温到t1℃,析出晶体的质量为 g,所得甲溶液溶质质量分数为 。
(4)取等质量的甲、乙、丙三种物质,分别配制成t2℃时的恰好饱和溶液,所得三种溶液的质量由大到小顺序为 。

溶液对于自然界中的生命活动和人类生产活动具有重要的意义,多角度认识溶液有助于指导我们的生活。
(1)关于溶液的说法,正确的是 (填写标号)
A.溶液中各部分的性质相同B.均一、稳定的液体一定是溶液
C.浓溶液不一定是饱和溶液D.溶液加水稀释后溶质的质量变小
(2)表Ⅰ是部分物质在20℃时的溶解性;表Ⅱ是氯化钠、碳酸钠在不同温度时的溶解度。
离子 |
OH﹣ |
Cl﹣ |
CO32﹣ |
SO42﹣ |
K+ |
溶 |
溶 |
溶 |
溶 |
Mg2+ |
不 |
溶 |
微 |
溶 |
Ba2+ |
溶 |
溶 |
不 |
不 |
表Ⅰ空格中应填写 ;分析表Ⅱ可知,氯化钠和碳酸钠的饱和溶液溶质质量分数相同时的温度是 。
温度 (℃) |
0 |
10 |
20 |
30 |
40 |
氯化钠(g) |
35 |
35.5 |
36 |
36.5 |
37 |
碳酸钠(g) |
6 |
10 |
18 |
36.5 |
50 |
(3)简单解释“夏天晒盐、冬天捞碱”的科学原理 。
硫酸锂(Li2SO4)和硝酸钾在不同温度时的溶解度如表:
温度/℃ |
0 |
10 |
20 |
30 |
40 |
|
溶解度/g |
Li2SO4 |
36.1 |
35.4 |
34.8 |
34.3 |
33.9 |
KNO3 |
13.3 |
20.9 |
31.6 |
45.8 |
63.9 |
|
请回答下列问题
(1)依据溶解度表,绘制溶解度曲线如图1所示,其中能表示Li2SO4溶解度曲线的是 乙 。(填“甲”或“乙”)
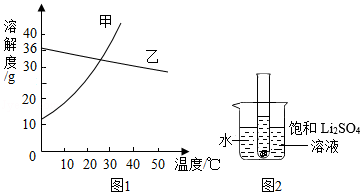
(2)Li2SO4和KNO3在某一温度时具有相同的溶解度x,则x的范围是 。
(3)40℃时,有含少量Li2SO4的KNO3饱和溶液,欲从中提纯KNO3晶体,方法是 。
(4)将10℃时两种物质的饱和溶液分别升温至30℃,所得Li2SO4溶液中溶质的质量分数 (填“>”、“<”或“=”)KNO3溶液中溶质的质量分数。
(5)如图2所示,20℃时,将盛有饱和Li2SO4溶液的试管放入盛水的烧杯中,向烧杯的水中加入某物质后,试管内有晶体析出。则加入的物质可以是 (填字母序号)。
①浓硫酸②冰块③生石灰固体④硝酸铵固体⑤氢氧化钠固体
A.②④B.①③⑤C.③④D.①②⑤
下表是氯化钠和碳酸钠在不同温度时的溶解度,根据此表回答:
| 温度(℃) |
10 |
20 |
30 |
40 |
|
| 溶解度(g) |
NaCl |
35.8 |
36.0 |
36.3 |
36.6 |
| Na 2CO 3 |
12.2 |
21.8 |
39.7 |
53.2 |
|
| |
|
|
|
|
|
(1)氯化钠与碳酸钠溶解度相等的温度范围是 ;40℃时,分别配制表中两种物质的饱和溶液,其中溶质质量分数较大的物质是 。
(2)写出一种将碳酸钠的不饱和溶液转化为饱和溶液的方法 。
(3)碳酸钠固体中混有少量的氯化钠,提纯碳酸钠的操作是:加水溶解→ → →过滤、洗涤、烘干。
(4)20℃时,取1.8g碳酸钠粉末加入试管中,先滴入几滴水,观察到粉末结块;再继续加入10mL水,振荡,用手触摸试管壁,感觉到发烫。下列有关说法正确的是 (填序号)。
a.滴入几滴水,粉末结块是由于生成了晶体(Na 2CO 3•10H 2O),该晶体属于混合物
b.碳酸钠溶于水时放热
c.加入10mL水,振荡,会观察到固体部分溶解
d.向所得的溶液中加入几滴酚酞试液,溶液呈红色
)1926年,我国著名化学家侯德榜先生创立了侯氏制碱法,促进了世界制碱技术的发展,该技术以从海水中提取出来的食盐(NaCl)为主要原料制取纯碱,同时得到可用作化学肥料的物质氯化铵(NH 4Cl),NaCl和NH 4Cl的溶解度曲线如图2所示,请回答下列问题:

①根据图2所示,t 2℃时,NH 4Cl的溶解度是 g。
②通过NaCl的溶解度曲线,可判断出海水"晒盐"是用 的方法从海水中得到NaCl(填写"蒸发结晶""降温结晶"之一)
③t 1℃时,将不同质量的NH 4Cl饱和溶液和NaCl饱和溶液均升温至t 2℃,此时,NH 4Cl溶液的溶质质量分数 NaCl溶液的溶质质量分数(填写"大于"等于"小于""无法判断"之一)。
我国化学家侯德榜创立的侯氏制碱法为纯碱工业技术的发展做出了杰出的贡献。在制备纯碱的过程中涉及Na2CO3、NaCl、NH4Cl、NaHCO3等物质。请结合表格数据回答下列问题:
温度/℃ |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|
溶解度/g |
Na2CO3 |
7 |
12.2 |
21.8 |
39.7 |
48.8 |
47.3 |
46.4 |
NH4Cl |
29.4 |
33.3 |
37.2 |
41.4 |
45.8 |
50.4 |
55.2 |
|
NaHCO3 |
6.9 |
8.2 |
9.6 |
11.1 |
12.7 |
14.5 |
16.4 |
|
(1)表中三种物质中,溶解性属于可溶的物质是 。
(2)在50℃时,向100g水中加入48gNa2CO3充分搅拌所得溶液质量为 ;保持烧杯中各物质质量不变,降温至40℃时,所得溶液溶质的质量分数会 (填“变小”、“不变”或“变大”)。
(3)请根据表格中数据,在如图中绘制出碳酸钠的溶解度曲线。

(4)根据溶解度曲线回答下列问题:
①60℃时,向等质量的上述四种固体物质中分别加水配成饱和溶液,所得溶液质量由大到小的顺序是 。
②侯氏制碱法的关键步骤是:先向饱和食盐水中通入氨气,制成饱和氨盐水,氨盐水吸收二氧化碳后生成碳酸氢钠和氯化铵,其化学方程式为NaCl+NH3+H2O+CO2=NH4Cl+NaHCO3.请问生成的碳酸氢钠和氯化铵,哪种物质首先析出,理由是 。
如图是A、B、C三种固体物质的溶解度曲线,请根据图示回答:
(1)t3℃时,将60gB物质加入到50g水中,充分搅拌后,所得溶液的质量是 g。
(2)图中P点所表示的B物质的溶液为 (填“饱和”或“不饱和”)溶液,欲将t1℃时C物质的不饱和溶液变为饱和溶液,可采用的方法是 (任写一种)。
(3)将t2℃时A、B、C三种物质的饱和溶液分别升温到t3℃(忽略水的蒸发),三种溶液的溶质质量分数由大到小的顺序是 。

如表是NaCl、NH4Cl在不同温度时的溶解度。
温度/℃ |
0 |
20 |
40 |
60 |
80 |
|
溶解度/g |
NaCl |
35.7 |
36.0 |
36.6 |
37.3 |
38.4 |
NH4Cl |
29.4 |
37.2 |
45.8 |
55.2 |
65.6 |
|
(1)以上两种物质的溶解度受温度影响较大的是 。
(2)40℃时,将40.6g NaCl加入到100g水中,充分搅拌使之溶解,所得溶液的质量为 g。
(3)20℃时,NaCl饱和溶液的溶质质量分数为(精确到小数点后1位) 。
试题篮
()