水是宝贵的自然资源。
(1)下列常用净水方法,可以降低水的硬度的是(填字母序号)。
A.过滤 B.吸附 C.蒸馏
(2)下图表示氯化钠、硝酸钾、硫酸镁三种物质的溶解度曲线。请回答:
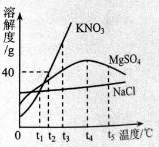
①
时,饱和溶液的溶质质量分数相同的两种物质是。
②
时,将40g硝酸钾放入60g水中,充分溶解后,所得溶液的质量为g。
③
时,溶解度最大的是。
④
时,其它条件不变,把硫酸镁饱和溶液升温到
,观察到的现象是。
⑤氯化钠溶液中含有少量硝酸钾杂质,提纯的方法是(填"蒸发溶剂"或"冷却热饱和溶液")。
如图是
、
、
三种固体物质的溶解度曲线图,请回答:

(1)
、
、
三种物质的溶解度受温度影响最大的是;
(2)t1℃时
的溶解度(填">"、"<"或"=")
的溶解度;
(3)在t2℃时,将15g
物质加入到50g水中,充分搅拌后,所得溶液中溶质的质量分数为。
下表列出了KNO3与NaCl在不同温度时的溶解度:
| 温度(℃) |
0 |
10 |
20 |
40 |
60 |
80 |
100 |
| KNO3的溶解度(g) |
13.3 |
20.9 |
31.6 |
63.9 |
110 |
169 |
246 |
| NaCl的溶解度(g) |
35.7 |
35.8 |
36.0 |
36.6 |
37.3 |
38.4 |
39.8 |
(1)现有含123gKNO3与17.9gNaCl的混合物,某同学设计了以下实验除去KNO3中的NaCl(操作过程中不考虑额外的水损失).
①向混合物中加入适量水,加热溶解;
②继续加热溶液至100℃并恒温蒸发浓缩;
③将溶液降温至10℃,仅得到KNO3晶体,过滤,将所得KNO3晶体洗涤并干燥.
A.步骤②中,为确保没有晶体析出,溶液中至少要保留 g水;
B.步骤③中,最多可得到KNO3晶体 g;
C.根据上述实验可概括出除去KNO3中少量NaCl的主要步骤:加热溶解→蒸发浓缩→ →过滤→洗涤→干燥;
D.洗涤时,应选用少量 (选填“热水”或“冷水”).其目的是: ;
(2)除去NaCl中少量KNO3的一种方法是:将NaCl和KNO3的混合物置于适量水中,加热,搅拌,待KNO3全部溶解,趁热过滤,将过滤所得的NaCl晶体进行洗涤和干燥.上述方法中,趁热过滤的目的是: .
(3)取23.4gNaCl和40.4gKNO3,加70g水,加热溶解.在100℃时蒸发掉50g水,维持该温度过滤,得到的晶体质量为 g;将滤液冷却至10℃,充分结晶,写出析出的晶体的化学式: .
如图是甲、乙、丙三种固体物质的溶解度曲线。

① P点的含义 。
② 要使接近饱和的甲溶液变成饱和溶液,可采用的方法有 (写出一种)。当甲溶液中含有少量乙时,可采用 的方法提纯甲。
③ t2℃时,将30 g甲物质放入50 g水的烧杯中,所得溶液溶质的质量分数为 (精确到0.1)。若烧杯内物质升温到t3℃(不考虑水蒸发),溶液中变化的是 。
Ⅰ.溶质的质量 Ⅱ.溶剂的质量 Ⅲ.溶质的质量分数
④ t2℃时,在含有50 g水的甲和乙的饱和溶液中,分别加入m g甲和m g乙,升温至t3℃,甲完全溶解,乙仍有剩余,则m的质量范围是 。
硫酸亚铁铵晶体俗称摩尔盐,化学式为FeSO4·(NH4)2SO4·6H2O,在制药、电镀方面有广泛的应用。某化学兴趣小组的学生用含有少量铜的废铁屑制备硫酸亚铁铵晶体,流程如下:
资料:①硫酸亚铁铵晶体易溶于水,不溶于酒精;硫酸亚铁铵晶体在100℃~110℃时分解。
②相关物质的溶解度(单位:g)如下表:
| 温度/℃ |
FeSO4 |
(NH4) 2SO4 |
FeSO4·(NH4)2SO4·6H2O |
| 10 |
20.0 |
73 |
17.2 |
| 20 |
26.5 |
75.4 |
21. 6 |
| 30 |
32.9 |
78 |
28.1 |
请回答下列问题:
(1)实验前,先用碳酸钠溶液浸泡废铁屑表面油渍。碳酸钠溶液可除去油渍是因为碳酸钠溶液的pH 7(选填“>”、“<”或“=”)。
(2)①中发生反应的化学方程式为 。
(3)操作①中过滤时,要趁热进行的原因是 ,过滤后得到的固体中一定含有的物质是 。
(4)操作③中使用无水酒精洗涤,可快速晾干。这样做的优点是 (填字母)。
A.避免用水洗涤所造成的晶体损耗
B.酒精易挥发,可低温晾干晶体
甲、乙两种固体物质的溶解度曲线如图所示.

(1)
时甲物质的溶解度是
;乙物质的溶解度随着温度的升高而(填"增大"或"减小");
(2)
时甲物质的饱和溶液中溶质的质量分数为;将
时甲、乙两种物质的饱和溶液分别降温至
,溶液中溶质质量分数大小关系是:甲(填"<"、"="或">")乙.
、
两种固体物质的溶解度曲线如图所示,请根据曲线图回答下列问题。
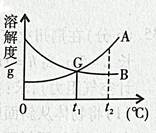
(1)现有常温下
的不饱和溶液,在只要求保持其中溶剂质量不变的条件下,将其变成饱和溶液,可行的方法有。
(2)现有一杯
时含
、
两种物质且均饱和的混合溶液,若要从中分离出少量A的纯净物,其操作方法是。
(3)下列说法正确的是。
①
时,
的溶液中溶质的质量分数一定比B的溶液中溶质的质量分数大;
② 将
,
、
的饱和溶液分别降温至
,此时两溶液中的质量分数相等;
③ 在
时,用两份等量的水分别配制成
、
的饱和溶液,这两种溶液的质量相等;
④ 在
时,用等量的
、
分别配制成两种饱和溶液,测得其质量依次为
和
,则
。
如图是甲、乙、丙(均不含结晶水)三种物质的溶解度曲线,请据图回答下列问题.

(1)在40℃时,甲、乙、丙三种物质的溶解度由大到小的关系是 (物质间用“>”连接);
(2)将30℃的三种物质的饱和溶液冷却到20℃后,所得溶液中溶质的质量分数由小到大的关系是:
(物质间用“<”连接);
(3)现有一定质量的B溶液,将该溶液在50℃下恒温蒸发10克水后析出了2克B晶体,再恒温蒸发5克水后,又析出了2克B晶体,则B物质在50℃时的溶解度是: .
溶解度是物质溶解性的定量表示,溶解度曲线可表示物质在不同温度下的溶解度。甲、乙两种物质的溶解度曲线如图所示,根据图示回答下列问题:

(1)甲、乙两种物质中溶解度受温度影响较大的是 物质。
(2)若甲物质中混有少量的乙物质,提纯甲物质最好采取的方法是 (填“降温结晶”或“蒸发结晶”)。
(3)t2℃时,乙物质的溶解度为 g;t2℃时,若将30g乙物质加入到50g水中,所得溶液的溶质质量分数是 (计算结果精确到0.1%)。
(4)将t1℃的甲、乙两物质的饱和溶液(均无固体物质剩余)升温到t2℃时,所得甲物质溶液的溶质质量分数 乙物质溶液的溶质质量分数(填“大于”“小于”“等于”之一)。
海水淡化可采用膜分离技术.如图一所示,对淡化膜右侧的海水加压,在其左侧得到淡水.其原理是海水中的水分子可以透过淡化膜,而其他各种离子不能透过。
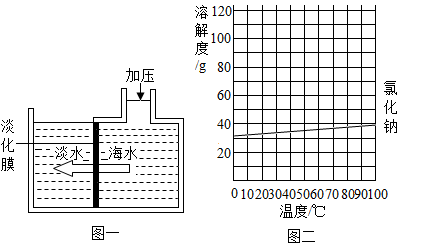
请回答:
(1)采用膜分离技术淡化海水的原理,与化学实验中常见的操作相似。
(2)对淡化膜右侧的海水加压后,海水中溶质的质量分数会(填"增大"、"减小"或"不变")。
(3)海水中含有大量的氯化钠,图二是氯化钠的溶解度曲线,据此可知盐场从海水中得到食盐晶体利用的方法是结晶(填"降温"或"蒸发")。
水是生命的源泉,下列变化与水相关。请回答:
①二氧化碳溶于水发生反应的化学方程式是 (1) 。
②自来水厂净水过程中常用到活性炭,其作用是 (2) 。
③铁丝在氧气中燃烧时,集气瓶内放少量水的目的是 (3) 。
④除去粗盐中泥沙等难溶性杂质的实验步骤:

I. 操作a的名称是 (4) ;
II. 三个步骤都用到的玻璃仪器是 (5) 。
⑤甲和乙两种固体物质(不含结晶水)的溶解度曲线如下图所示,回答下列问题:
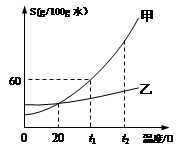
I.在 (6) ℃时,甲和乙两种物质的溶解度相等。
II.t1℃时,将50g固体甲加到50g水中,充分搅拌后所得溶液的质量为 (7) g。
III.甲的饱和溶液中含有少量的乙,由该液体得到固体甲采用的方法是 (8) 。
IV.若将甲物质的不饱和溶液变为饱和溶液,下列说法正确的是 (9) 。
A.溶剂的质量一定变小 B.溶质的质量可能不变
C.溶质的质量分数一定变大 D.溶液的质量变大
⑥下图是对20℃一定质量的丙溶液进行恒温蒸发结晶的实验过程,请回答:
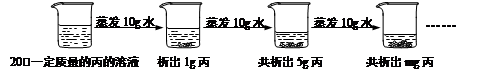
I.蒸发前原溶液是 (10) (填“饱和”或“不饱和”)溶液;m的数值是 (11) 。
II.依据上述实验,你认为丙的溶解度随温度变化的趋势是 (12) (填字母)。
A.随温度升高而增大 B.随温度升高而减小 C.无法判断
甲、乙、丙三种物质的溶解度曲线如图所示.据图回答:

30℃时,甲、乙、丙三种物质的溶解度由大到小的顺序为 ;要使接近饱和的丙物质溶液变为饱和,可采取的一种措施是 ;50℃时,将等质量的甲、乙、丙三种物质的饱和溶液同时降温至10℃时,析出晶体最多的是 ,所得溶液中溶质质量分数最小的是 [50℃时,30g乙物质加入到50g水中不断搅拌,所得溶液的质量是 .
如图是
,
,
三种固体物质的溶解度曲线,请回答下列问题:

(1)
点的含义是;
(2)若
点混有少量
时,可采用的方法提纯
;
(3)
℃时,能不能配制溶质的质量分数为40%的
溶液?(填"能"或"不能");
(4)
℃时,将
,
,
三种固体物质各30
加入到100
水中,充分溶解,形成不饱和溶液的是;
(5)将
℃时
,
,
三种固体物质的饱和溶液升温到
℃,其溶质的质量分数由大到小的顺序是。
20℃时,将等质量的甲、乙两种固体(不含结晶水),分别加入到盛有100g水的烧杯中,充分搅拌后现象如图1所示,加热到50℃时现象如图2所示,甲、乙两种物质的溶解度曲线如图3所示。

请回答下列问题:
(1)图1中一定是饱和溶液的是溶液(填"甲"或"乙");图2中乙溶液一定是溶液(填"饱和"或"不饱和")。
(2)图3中表示乙的溶解度曲线的是(填"M"或"N");图2中乙溶液降温至30℃析出晶体(填"会"或"不会")。
(3)50℃时甲的饱和溶液中溶质质量分数为(计算结果精确到0.1%)。
下图为几种固体的溶解度曲线,回答下列问题:

(1)
的溶解度随温度变化的规律是。
(2)30℃时,
溶液的最大浓度(溶质质量分数)为(只列计算式,不需要计算结果)。
(3)60℃时,10g 和90g 完全溶解于100g蒸馏水, 冷却到30℃后,("有"或"没有") 析出,有g 结晶析出。
试题篮
()