分析处理图表中的信息是学习化学的一种重要方法。
(1)表3是氯化钠和碳酸钠在不同温度时的溶解度,根据此表回答:

① 40
时,氯化钠的溶解度为g。
②碳酸钠的溶解度随温度的升高而(填"增大"或"减小")。在20
时,将100g的水加入30 g碳酸钠中,充分搅拌后得到的是(填"饱和溶液"或"不饱和溶液"),将上述溶液升温到30度,该溶液的溶质质量分数为(计算结果精确到0.1%)。
③10
时,分别配制表中两种物质的饱和溶液,其中溶质质量分数较小的物质是。
(2)将足量的稀盐酸加入一定量的铁、铜混合物中,写出其中反应的化学方程式。图7是实验过程生成气体或剩余固体的质量随反应时间的变化关系,其中表示正确的是(填标号)。

如图是a、b、c三种固体物质的溶解度曲线

(1)在t1℃时,a、b、c三种物质中,溶解度最大的是 ;
(2)t1℃时,将30g a物质放入100g水中,充分搅拌,所形成的溶液是 溶液(填“饱和”或“不饱和”);溶液中溶质的质量分数是 (精确到0.1%);此时若将温度由t1℃升至t2℃,还应再加入a物质 g,才能变成饱和溶液。
(3)从a、c的饱和溶液中提取a,应采用方法是 (填“冷却结晶”或“蒸发溶剂”)。
(1)下图是不与水发生化学反应的a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点。据图回答:
①P 点的含义是 。
②t 2℃时a、b、c三种物质的溶解度按由小到大的顺序排列是 (填写物质序号)。
③t 2℃时30ga物质加入到50g水中不断搅拌,所得溶液的溶质质量分数 。
④将t1℃时a、b、c三种物质饱和溶液的温度升高到t2℃时,三种溶液的溶质质量分数大小关系是 (填写选项序号)。
| A.c>a=b | B.a=b>c | C.a>b>c | D.b>a>c |
(2)根据下表回答:
| |
OH- |
NO3- |
Cl- |
SO42- |
CO32- |
| H+ |
|
溶、挥 |
溶、挥 |
溶 |
溶、挥 |
| Na+ |
溶 |
溶 |
溶 |
溶 |
溶 |
| Ca2+ |
微溶 |
溶 |
溶 |
微溶 |
不溶 |
| Cu2+ |
不溶 |
溶 |
溶 |
溶 |
不溶 |
| Ba2+ |
溶 |
溶 |
溶 |
不溶 |
不溶 |
| Zn2+ |
不溶 |
溶 |
溶 |
溶 |
不溶 |
①BaCO3的溶解性 。从上表中找出一种不溶碱 (填化学式)。
②Zn(NO3)2、BaCl2两种溶液能不能发生反应? (填:能”或“不能”)
③利用上表写一个有氢氧化铜生成的复分解反应化学方程式: 。
下表是KNO3、NaCl在不同温度下的部分溶解度数据,请回答问题:
| 温度(℃) |
10 |
20 |
40 |
60 |
80 |
| KNO3 |
20.9 |
31.6 |
63.9 |
110 |
169 |
| NaCl |
35.8 |
36 |
36.6 |
37.3 |
38.4 |
(1)40℃时,将70gKNO3固体加入100g水中,充分搅拌,形成的溶液质量为 g。
(2)60℃时,KNO3的饱和溶液中含有少量NaCl,可通过 方法获得较纯净的KNO3晶体。
(3)t℃时,NaCl和KNO3的饱和溶液溶质质量分数相同,该温度范围是 。
A.10℃~20℃ B.20℃~40℃ C.40℃~60℃ D.60℃~80℃
(4)向20mL水中溶解一定量KNO3固体的操作如下图:请根据实验现象和溶解度数据回答:A、B、C中溶液一定不饱和溶液的是 。当x = g时,B中恰好没有固体剩余。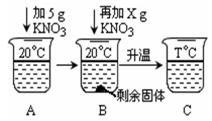
如图是A、B固体物质的溶解度曲线
(1)将t2℃时32g A物质的饱和溶液蒸干,理论上可以得到A物质的质量是 g。
(2)将t2℃两种物质的饱和溶液降温到t1℃,溶液中溶质的质量分数是A B(填“大于”“小于”“等于”)。
(3)若A物质中混有少量的B物质,可以用 方法提纯A。
(4)现有B物质的不饱和溶液,可以用 的方法使之变为饱和溶液(填“升高温度”“降低温度”)。
如图甲是A、B、C三种固体物质的溶解度曲线图。
(1)甲图中,t2℃时,A、B、C三种物质中,溶解度最大的是 ,P点所表示的含义为 。
(2)①将t2℃时A、B、C三种物质的饱和溶液降温到t1℃时三种物质的溶质质量分数由大到小的顺序是 ;
②如乙图所示,20℃时,把试管放入盛有X的饱和溶液的烧杯中,在试管中加入几小段镁条,再加入5mL稀盐酸,立即产生大量的气泡,同时烧杯中出现浑浊,则X可能为A、B、C三种固体物质中的哪一种? 。
下图是甲、乙、丙三种物质的溶解度曲线,根据溶解度曲线回答下列问题:
(1)t1℃时,将接近饱和的丙溶液变成饱和溶液,写出其中的一种方法 。
(2)将甲、乙、丙三种物质饱和溶液的温度分别从t1℃时升到t2℃时,溶液中溶质的质量分数最大的是__________。
(3)t2℃时,将50g的甲物质溶解在50g水中,充分溶解并恢复到原来温度后,得到溶液的溶质质量分数为 (精确到0.1%)。
(4)t2℃时,甲物质饱和溶液中,溶质和溶液的质量最简比为 。
A、B、C三个烧杯中都盛有50g水(其中A、C烧杯中水温为10℃,B烧杯中水温为30℃,不考虑溶解过程中温度的变化),向三杯水中分别加入甲、乙两物质各10g,充分搅拌后所得现象如下图所示,根据甲、乙的溶解度随温度的变化图像。试回答:
(1)若要将B烧杯中的溶液变为该温度下甲的饱和溶液,还需要加入甲 克。
(2)其它条件不变,将C烧杯中的温度升到30"C时,C烧杯中的溶液是 (填“饱和”或“不饱和”)溶液。
(3)10℃时,以上A、C烧杯中的溶液质量分数关系为A C(填“=”或“>”、“<”,下同)。若其他条件不变,将温度升高,则A、C烧杯中的溶液质量分数关系为A C。
(5分)下图是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点。据图回答:
① P点的含义是 。
② t2℃时a、b、c三种物质的溶解度由大到小的排列顺序是 。
③ t2℃时将30g a物质加入到50g水中充分溶解,所得溶液是 (填“饱和”或“不饱和”),溶液质量是 g。
④ 将t1℃时a、b、c三种物质的饱和溶液分别升温到t2℃,三种溶液的溶质质量分数大小关系是 。
Ⅰ.b>a=c Ⅱ.a=b>c Ⅲ.a>b>c Ⅳ.b>a>c
甲、乙两种固体(无结晶水)的溶解度曲线如图。
①图中a点的含义是( 11 ) ;
②40℃时,50g水中最多溶解( 12 ) g甲;
③正确的说法是( 13 )
| A.20℃时,甲、乙溶液所含溶质质量相等 |
| B.40℃时,将10%的甲溶液降温至20℃,其溶质质量分数减小 |
| C.40℃时,分别向100g水中加入35g甲、乙,所得溶液的溶质质量分数:甲>乙 |
| D.40℃时,甲、乙两杯饱和溶液所含溶质质量相同,则溶液质量的大小关系:甲<乙 |
我国既是陆地大国,又是是海洋大国,拥有丰富的海洋资源,开发前景广阔。我们食用的食盐,大部分是从海水中得到的,我国海水“晒盐”历史悠久。
(1)盐场海水晒盐的原理是________(填序号)。
A.氯化钠的溶解度受温度影响变化较大,故采取降温结晶的方法
B.因氯化钠溶解度受温度影响变化不大,故采取蒸发水分的方法
(2)晒盐得到粗盐,主要含泥沙、氯化镁等杂质,需要提纯,主要操作流程如下: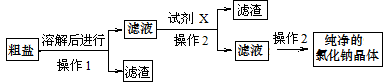
①操作1的名称是________。
②操作1过程中玻璃棒的作用是________
③试剂X是________(选择合适的序号填空)
A.NaOH溶液 B.KOH溶液 C.稀硫酸 D.稀盐酸
(3)我国化学家侯德榜创立的侯氏制碱法,就是以海水“晒盐”得到的氯化钠为原料,制得纯碱(Na2CO3)。Na2CO3和NaCl的溶解度曲线如图所示,下列叙述中正确的是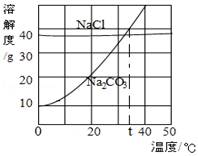
A.NaCl的溶解度大于Na2CO3的溶解度
B.t℃时,Na2CO3和NaCl的饱和溶液中溶质的质量相同
C.20℃时,100g Na2CO3饱和溶液中含有20g Na2CO3
D.当Na2CO3中含有少量的NaCl时,可用降温结晶的方法提纯Na2CO3
我国化学家侯德榜创立的侯氏制碱法,就是以海水晒盐得到的氯化钠为原料,制得纯碱碳酸钠,碳酸钠和氯化钠的溶解度曲线如图所示,试回答下列问题: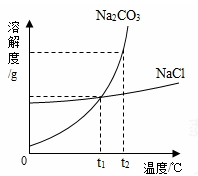
(1)t2℃时,氯化钠的溶解度 碳酸钠的溶解度。(填“大于”“小于”“等于”之一)。)
(2)我国某些盐湖出产天然碱(主要成分是纯碱,并含有少量氯化钠杂质)。在实验室里,从天然碱中分离出较纯净的纯碱晶体应采用 的方法。
(3)在实验室中,若要测定盐湖水的酸碱性强弱,可以使用 测定。
(4)氯化钠通常采取海水晒盐的方法获得,其原因是 。
(5)在侯氏制碱法中碳酸钠是由碳酸氢钠加热分解得到的,试写出你所了解的碳酸氢钠在生活中的一项用途: 。
溶液在生命活动和生产、生活中都起到十分重要的作用。在一定温度下,向质量均为50g的4份水中分别加入一定量的KNO3固体,搅拌至充分溶解,(如有不溶的KNO3固体用过滤的方法除去),得到溶液。加入KNO3固体的质量与所得溶液的质量如下表:
| 实验编号 |
a |
b |
c |
d |
| 加入KNO3固体的质量 |
45 |
50 |
55 |
60 |
| 所得溶液的质量 |
95 |
100 |
105 |
105 |
(1)实验a、b、c、d中,有未被溶解的KNO3固体的实验是 (填写实验编号);
(2)实验a、b、c、d所得溶液中,溶质质量分数大小关系为 ;
(3)取实验b所得溶液,若使其溶质质量分数变为20%,在不改变温度的情况下,可以采取的操作是 。
A、B、C三种物质的溶解度曲线如图所示,请回答

①A、B、C三种物质中随温度升高溶解度减小的是 。
②t2℃时4gB物质放入10g水中充分溶解得到13g溶液,t2℃时B的溶解度是 。
③A固体中混有少量B,得到较纯净的A固体的方法是: 。
④t3℃的A、B、C三种物质的饱和溶液降温至t1℃,此时溶液中溶质质量分数由大到小的关系是 。
下表是Ca(OH)2和NaOH的溶解度数据。请回答下列问题:
| 温度/℃ |
0 |
20 |
40 |
60 |
80 |
100 |
|
| 溶解度/g |
Ca(OH)2 |
0.19 |
0.17 |
0.14 |
0.12 |
0.09 |
0.08 |
| NaOH |
31 |
91 |
111 |
129 |
313 |
336 |
|
(1)依据上表数据,绘制Ca(OH)2和NaOH的溶解度曲线,下图中能表示NaOH溶解度曲线的是 (填A或B)。

(2)要想把一瓶接近饱和的Ca(OH)2溶液变成饱和溶液,具体措施有:
①加入氢氧化钙,②升高温度,③降低温度,④加入水,⑤蒸发水后再恢复到原温度,⑥加入生石灰。
其中措施正确的是 。
A.②④⑥ B.③④ C.①③⑤⑥ D.①②⑤⑥
(3)20℃时,191g饱和NaOH溶液,蒸发10g水后,再降温到20℃,可析出NaOH晶体的质量为 。
(4)现有20℃时Ca(OH)2的饱和溶液(甲溶液),向其中加入一定量CaO后得到的溶液(乙溶液),此时溶液中溶质的质量分数乙 甲(填“>”、“<”或“=”)。
(5)现有60℃时含Ca(OH)2和NaOH两种溶质的饱和溶液,若要得到较纯净的NaOH晶体,应采取的物理方法是 。
(6)20℃时,欲测定NaOH溶液的pH,若先将pH试纸用蒸馏水润湿,再进行测定,则所测溶液的pH (填“偏大”、“偏小”或“不受影响”)。
试题篮
()