下图是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点.据图回答:
温度为 时,a与c两物质的溶解度相等;在三物质中, 物质(填序号)的溶解能力受温度影响最大。
(2)t2℃时,35ga物质加入到50g水中不断搅拌,形成的溶液质量是_________g;
(3)t2℃时,用100g水与一定质量a物质恰好配成饱和溶液。若要把该饱和溶液稀释成质量分数为10%的溶液,应加水 g。
(4)在t2℃时,将等质量的a、b、c三种物质的饱和溶液同时降温至t1℃时,析出晶体最多的是_________。
1926年,我国著名化学家侯德榜先生创立了一种高效环保的纯碱生产方法 ——“联合制碱法”,又称侯氏制碱法。其生产过程中有下列反应:
(1)在反应①中,生成的氯化铵和碳酸氢钠的
质量比是53.5:____ 。
(2)如图为碳酸氢钠和氯化铵的溶解度曲线,30℃时,碳酸氢钠饱和溶液中的溶质质量分骜 (填“大于”、“等于”或“小于”)氯化铵饱和溶液中的溶质质量分数。
(3)氨盐水吸收C02后生成了碳酸氢钠和氯化铵,请你根据溶解度曲线和生成物质量关系分析:为何碳酸氢钠首先结晶析出?
下图是甲、乙两种固体物质的溶解度曲线。

(1)溶解度随温度升高而减小的物质是____ __。
(2)t1℃时,甲、乙两种物质的溶解度 。
(3)要使乙的饱和溶液变为不饱和溶液,除加水之外还可
采用的方法是 。
(4)要使甲从其饱和溶液中析出,可用 的方法。
(5)t2℃时,甲的饱和溶液中溶质的质量分数是 。
水是重要的自然资源,在生产、生活和科研中有重要意义。
①下图是水的电解实验,反应的化学方程是为(8),正极产生的气体为(9), 如果试管1中产生气体的分子数为6.02×1023个,则试管1中产生气体的质量为(10)g。
②水是一种最常用的溶剂。在A、B、C、D四个烧杯中分别装有等量的
水,在t℃时,向A、B、C烧杯中分别加入25g、15g、5g甲物质,向D
烧杯加入25g乙物质,充分溶解后,静置,现象如下图1所示。

回答下列问题:
Ⅰ.在图1四个烧杯的溶液中,(11)(填“A”、“B”、“C”或“D”)烧杯中的溶液一定是饱和溶液。
Ⅱ.图2分别为两种物质的溶解度曲线,其中可表示乙物质的是(12)(填“a”或“b”);要使A烧杯中剩余固体继续溶解,可采用的方法是(13)。
Ⅲ.室温下,将一瓶a溶液敞口放置一段时间,溶质质量分数由5%变了10%,放置前后溶液中所含水(溶剂)的质量比为(14)。
如图是a、b两种固体物质的溶解度曲线,试回答:
(1)t℃时,两种固体物质的溶解度大小关系为a b(填“>”“<”“=”);
(2)当a中含有少量b时,可以用 法提纯a.
不同温度下,碳酸钠和碳酸氢钠的溶解度如下表所示
| 温度/℃ 溶解度 |
0 |
20 |
40 |
60 |
| 碳酸钠 |
7.0 |
21.8 |
48.8 |
46.4 |
| 碳酸氢钠 |
6.9 |
9.6 |
12.7 |
16.4 |
(碳酸钠、碳酸氢钠)俗称小苏打(请在选择的物质下面划线)。
(2)服用碳酸氢钠治疗胃酸过多时,胃液的pH (填“增大”、“减小”或“不变”),发生反应的化学方程式是 。
(3)为区分碳酸钠和碳酸氢钠两种白色固体。在20℃时,各盛有50 mL水的甲、乙两烧杯中,分别加入等质量的碳酸钠和碳酸氢钠固体,充分溶解后,现象如图所示。乙烧杯中加入的物质是 (填化学式),加入的质量m的范围为: 。
溶解度曲线为我们定量描述物质的溶解性强弱提供了便利。请你根据下图的溶解度曲线回答下列问题: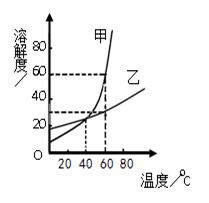
(1)溶解度的单位是 ;
(2)在 温度范围内,乙物质的溶解度大于甲物质的溶解度;
(3)20℃将30g甲物质溶解于50g水中,得到的是 (填“饱和”或“不饱和”)溶液
(4)60℃时,乙物质的饱和溶液的质量分数为 ;(用分数表示,不用化为小数)
(5)40℃时,甲乙两物质的溶解度相等,有关这两种物质饱和溶液的性质描述一定正确的是 。(选填编号)
| A.溶液质量一定相等 |
| B.溶液的密度一定相等 |
| C.溶液的质量分数一定相等 |
| D.如果降温到 20℃,甲、乙两溶液的质量分数仍然相等 |
如图所示是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点。
根据图示回答:
(1)P点的含义是 。
(2)在不改变溶液的溶质质量分数的情况下,把c物质的不饱和溶液变成饱和溶液的方法是 。
(3)t2℃时40g a物质加入到60g水中不断搅拌,溶液质量为 g。
(4)将t1℃a、b、c三种物质饱和溶液升温至t2℃时,三种溶液的溶质质量分数大小关系是 (填选项序号)。
Ⅰ.a>b=c Ⅱ.a=b>c Ⅲ.a>b>c Ⅳ.b > a >c
如图为NaCl、KNO3的溶解度曲线。
(1)20℃时,NaCl的溶解度是 。
(2)20℃时,将20gNaCl固体投入到50g水中,得到的是NaCl的 (填“饱和”或“不饱和”)溶液,此时溶液中溶质的质量分数是 (保留到0.1%)。
(3)除去KNO3固体中混有的少量NaCl,提纯的步骤是:加水溶解、蒸发浓缩、 ,然后过滤、洗涤、干燥。
(4)某同学在20℃时进行了如下实验,得到相应的溶液①~⑤,下列说法正确的是 
| A.向④加入4.5gKNO3即可达到饱和 | B.②③⑤中溶质的质量分数相等 |
| C.①③④均为KNO3的不饱和溶液 | D.④→⑤可析出53.9gKNO3晶体 |
根据如图所示A、B两种物质的溶解度曲线回答:
(1)温度在__________范围内,B的溶解度大于A的溶解度.
(2)A、B两物质溶解度相等时的温度是__________.
(3)t2℃时,A物质的溶解度是__________.
向20℃的饱和石灰水中加入少量氧化钙(CaO)粉末,至充分反应(化学方程式为:CaO+H2O═Ca(OH)2),请结合题目信息和下图熟石灰溶解度曲线回答:
(1)加入氧化钙粉末后,溶液的温度将 (升高、降低或不变);
(2)反应后溶液的质量跟原石灰水相比将会 (增加、减少或不变)
(3)反应后溶液温度恢复至20℃,跟原石灰水相比,溶质质量分数 不变
(增加、减小或不变);
甲、乙两种物质的溶解度曲线如图。
(1)10℃时,甲物质的溶解度 (填“大于”、“小于”或“等于”)乙物质的溶解度。20℃时,50克水最多能溶解甲物质 g 。
(2)40℃时,把40g甲物质放入100g水中,所得的是 (填“饱和”或“不饱和”)溶液。
(3)40℃时,有等质量的甲、乙饱和溶液各一杯(有甲溶质的为甲杯,有乙溶质为乙杯),当把它们的温度都降到20℃时。下列说法正确的是 (填序号)。
| A.溶质质量分数:甲=乙 |
| B.溶剂质量:甲<乙 |
| C.甲和乙都有晶体析出 |
| D.甲溶液质量不变 |
(4)20℃时,在90 g10%的乙溶液中加入30 g乙固体,充分搅拌,所得溶液的溶质质量分数为 (保留一位小数)。
图1是甲、乙两种物质的溶解度曲线,图2所示两个烧杯中各盛有20℃时上述两种物质的饱和溶液。请你通过分析,回答下列问题:
(1)溶解度随温度升高而增大的物质是 (填“甲”或“乙”);
(2)80℃时,100 g水中最多可溶解甲物质 g,该饱和溶液中溶质的质量分数为 。
(3)当温度由20℃升高至60℃时(不考虑水分蒸发),B烧杯中固体质量增加,则B烧杯溶液中的溶质是 (填“甲”或“乙”)。
(4)由图1分析,若分别将200 g甲、乙的饱和溶液从80℃降温到40℃,对所得溶液的叙述正确的是 (填序号)。
A.甲、乙都是饱和溶液 B.所含溶剂质量:甲<乙
C.溶液质量:甲>乙 D.溶质质量分数:甲>乙
(5)甲中混有少量乙,如果要提纯甲,分离的实验操作步骤主要有:①称量需提纯的固体混合物;②控制水量,配制成80℃左右的饱和溶液; ③降温至20℃后进行过滤,并用少量冷水洗涤过滤器中的固体2-3次;④取出固体,干燥、包装。
请回答:步骤③中,过滤后,需进行洗涤,目的是 。
不用热水而用冷水洗涤的原因是 。
(6)有同学做了以下实验,请仔细观察下图中实验过程和溶液的变化并回答问题。
在A、B、C 中Ca(OH)2 溶液的溶质质量分数的大小关系是 。
水和溶液在生命活动和生产、生活中起着十分重要的作用。
(1)“生命吸管”(如图)是一种可以随身携带的小型水净化器,里面装有网丝,注入了活性炭和碘的树脂等。其中活性炭起到________________和过滤的作用。
(2)水常用来配制各种溶液,硝酸钾溶液中的溶质为_________________。
(3)农业生产常用溶质的质量分数为10%~20%的NaCl溶液来选种。现将300 g 25%的NaCl溶液稀释为15%的NaCl溶液,需要加水的质量为__________g。
(4)根据下表回答问题。
| 温度/℃ |
0 |
20 |
40 |
60 |
80 |
100 |
|
| 溶解度/g |
NaCl |
35.7 |
36.0 |
36.6 |
37.3 |
38.4 |
39.8 |
| NH4Cl |
29.4 |
37.2 |
45.8 |
55.2 |
65.6 |
77.3 |
①60 ℃时,向两个分别盛有50 g NaCl和NH4Cl的烧杯中,各加入100 g的水,充分溶解后,为饱和溶液的是____________溶液。
②采用一种操作方法,将上述烧杯中的剩余固体全部溶解,变为不饱和溶液。下列说法正确的是___________(填字母序号)。
A.溶质的质量不变
B.溶液中溶质的质量分数一定减小
C.溶液质量可能不变
D.可升高温度或增加溶剂
小玉帮助老师配制KNO3的饱和溶液,以备全班实验使用。此实验室温度为25 ℃,老师提供的药品是含有少量NaCl的KNO3固体。
(1)他查阅了两种物质的溶解度曲线,如图1所示。25 ℃时,KNO3的溶解度是___________g,经分析KNO3中混有少量NaCl的提纯方法是______________,用此法获得了足量的KNO3固体。
(2)小玉配制700 g KNO3饱和溶液的过程如下:
①计算;
②称量:准确称量KNO3固体__________g;
③量取:用____________(填“100 mL”“500 mL”或“1 000 mL”)量筒量取蒸馏水,操作如图2所示;
④溶解:将KNO3和水分别加入大烧杯中,搅拌使固体完全溶解。
请指出小玉在配制溶液过程中的操作错误_____________。由于以上错误操作,他配得的不是KNO3饱和溶液,要得到该温度下的饱和溶液,他可能采用的方法是___________________________。最后小玉将配得的饱和溶液装瓶,贴上标签备用。
试题篮
()