下图是A.B两种固体物质的溶解度曲线。请回答下列问题:
(1)温度为 ℃时,A与B饱和溶液中溶质的质量分数相等。
(2)t2℃时,将60g A物质放入100g水中,充分搅拌,所得溶液的质量是 g,所得溶液的溶质质量分数是 。
(3)将接近饱和的A溶液变成饱和溶液的方法有 、 (答出两种方法)。
四个图像分别对应四个变化过程,其中正确的是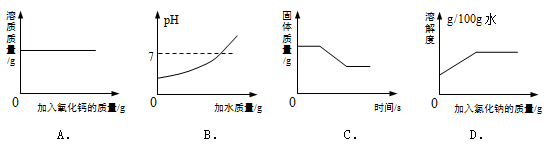
| A.一定量的饱和石灰水中加入氧化钙 |
B.向 的溶液中加水 的溶液中加水 |
| C.高温煅烧一定质量的石灰石 |
| D.t℃时,在一定量的氯化钠不饱和溶液中不断加入氯化钠固体 |
溶解度可以表示物质溶解性的大小。
① 下表是KNO3在不同温度下的溶解度。
| 温度/℃ |
0 |
20 |
40 |
60 |
80 |
100 |
| 溶解度(g/100g水) |
13.3 |
31.6 |
63.9 |
x |
169 |
246 |
Ⅰ.40℃时,硝酸钾的溶解度为 (8) g/100g水。
Ⅱ.40℃时将31 g KNO3固体放入50 g水中,所得溶液为 (9) 溶液(填“饱和”或“不饱和”),若降温到20℃能析出固体 (10) g。
Ⅲ.为测定x的值,取4份60℃的水各50 g,分别进行实验,并记录数据如下表:
| 实验编号 |
甲 |
乙 |
丙 |
丁 |
| KNO3质量/g |
40 |
50 |
60 |
70 |
| H2O质量/g |
50 |
50 |
50 |
50 |
| 溶液质量/g |
90 |
100 |
105 |
105 |
由实验可知 (11)
A.甲所得溶液中溶质质量分数为80%
B.乙恰好形成60℃时的饱和溶液
C.丙和丁所得溶液溶质质量分数相等
D.60℃时KNO3的溶解度为110g/100g水
②气体的溶解度也有一定的变化规律。不同温度下,氧气的溶解度随压强变化如图所示,图中t1对应的温度为40℃,则t2对应的温度 (12)
A.小于40℃ B.等于40℃ C.大于40℃ D.无法确定
下图是常见固体物质的溶解度曲线,根据图示回答:
①d点的意义是 (8) 。t1℃时,60g水中最多溶解A物质 (9) g。
②t2℃时A、B、C的相同质量饱和溶液中,溶剂质量由大到小顺序是 (10) 。(用“>”“<”“=”表示)
③将t1℃ 一定量A的饱和溶液升温至t3℃时,可用图上的(11) 点表示;若要将图中“b”点表示A的溶液情况变为“c”点,宜采取的方法是 (12) 。
④若将t3℃三种物质的饱和溶液分别降温到t1℃,则对所得三种溶液说法正确是 (13) (析出晶体都不含结晶水)。
Ⅰ.都是饱和溶液 Ⅱ.溶质的质量分数:B>C>A
Ⅲ.溶剂质量都不变 Ⅳ.析出溶质的质量:A>B>C
常温下,在两个各盛有100mL水的烧杯中,分别加入相同质量的甲、乙两种物质,使其充分溶解,并恢复到原温度,结果如下图所示。下列说法中正确的是
| A.该温度下的溶解度:甲>乙 | B.升高温度,剩余的甲固体继续溶解 |
| C.甲溶液可能是饱和溶液 | D.乙溶液可能是饱和溶液 |
如图是甲、乙两种物质的溶解度曲线,请结合图回答问题:
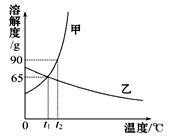
(1) ℃时,甲、乙两种物质的溶解度相等。
(2)溶解度随温度升高而降低的物质是 (填“甲”或“乙”)。
(3)可使甲物质从其饱和溶液中结晶析出的方法是 。
(4)t2℃时,分别将甲、乙两种物质的饱和溶液降温到t1℃,甲溶液的溶质质量分数 乙溶液的溶质质量分数。(填“大于”“等于”或“小于”)。
(5)小明同学用甲物质进行以下实验:
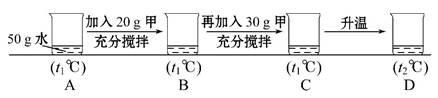
①实验过程中,B、C、D对应的溶液为不饱和溶液的是 。
②向B对应的溶液中再加入30 g甲固体的过程中,发现固体全部溶解,一段时间后又有部分固体析出。你认为“全部溶解”的原因是 。
如图是A、B、C三种固体物质的溶解度曲线。

(1)P点的含义: ;
(2)当温度为t2℃时,A、B、C三种物质的溶解度由小到大的顺序 。
(3)将t2℃时A、B、C三种物质的饱和溶液降温到t1℃时,所得溶液中溶质质量分数由大到小的顺序为 。
(4)当A中含有少量B时,为了得到纯净的A,可采用 的方法。
甲、乙两种固体物质(不含结晶水)的溶解度曲线如图所示,下列说法正确的是( )

A.t1℃时,甲、乙的溶液中所含溶质质量相等
B.t2℃时,将50g甲加入50g水中,可得到100g溶液
C.甲中含有少量乙时,可用降温结晶法提纯甲
D.t1℃时,分别将甲、乙的饱和溶液升温至t2℃,所得溶液的溶质质量分数甲>乙
人类的日常生活和工农业生产离不开水。请回答:
(1)水__ ________(填“属于”或“不属于”)人类所需的六大基本营养素之一。
(2)含有较多可溶性钙、镁化合物的水叫做____________(填“软水”或“硬水”)。
(3)下列净化水的单一操作中,相对净化程度较高的是__________ _(填字母)。
A.静置沉淀 B.吸附沉淀 C.蒸馏
(4)水在通电的条件下可以分解,写出该反应的化学方程式__ __。
(5)甲和乙两种固体物质的溶解度曲线如右下图所示,回答下列问题:

①在__ __℃时,甲和乙两种物质的溶解度相等。
②将t1 ℃时等质量的甲和乙两种物质的饱和溶液分别降温到0 ℃,析出固体质量较少的是______(填“甲”或“乙”)。
③t2 ℃时,将60 g甲物质放入100 g水中,充分搅拌,所得溶液的溶质质量分数w(甲)与同温下乙物质的饱和溶液的溶质质量分数w(乙)大小关系为________ __(填字母)。
A.w(甲)<w(乙) B.w(甲)>w(乙)
C.w(甲)=w(乙) D.无法确定
a、b两种物质的溶解度曲线如图所示。下列说法不正确的是
| A.将t1℃时b的饱和溶液加水可变为不饱和溶液 |
| B.将t2 ℃时a的饱和溶液降温至t1 ℃,溶液质量不变 |
| C.t2 ℃时,两种物质的饱和溶液中溶质质量分数a>b |
| D.将t2 ℃时a、b的饱和溶液分别降温至t1 ℃,两溶液的溶质质量分数相等 |
NaCl和KNO3在不同温度时的溶解度如下表。下列说法错误的是( )
温度/℃ |
0 |
20 |
40 |
60 |
NaCl的溶解度/g |
35.7 |
36.0 |
36.6 |
37.3 |
KNO3的溶解度/g |
13.3 |
31.6 |
63.9 |
110 |
A.20℃时,100g H2O最多能溶解36.0g NaCl
B.40℃时,KNO3饱和溶液的溶质质量分数小于63.9%
C.可用冷却海水的方法获取大量食盐
D.其他条件不变,升温可将KNO3饱和溶液变为不饱和溶液
甲、乙、丙三种固体物质的溶解度曲线如图所示,从中获取的信息正确的是( )

A.蒸发溶剂可使丙的饱和溶液变为不饱和溶液
B.t2℃时,100g甲的饱和溶液降温至t1℃,析出甲的质量为15g
C.t1℃时,甲、乙、丙三种溶液所含溶质的质量可能相同
D.t2℃时,甲、乙、丙的饱和溶液降温至t1℃,所得溶液的溶质质量分数大小顺序为乙>甲=丙
海水中的化学
(1)人们从海水中可以获得很多有用的物质。如①淡水、②食盐、③镁等。获取这几种物质主要通过物理变化的是 ;需要发生化学变化的是 (填编号)。

(2)海水中含有较多的硫酸钠。硫酸钠是制造纸浆、燃料稀释剂、医药用品等的重要原料。某硫酸钠粗品中含有少量的硫酸钙、硫酸镁,实验室进行提纯的流程如下:
回答下列问题:
①用氢氧化钠和碳酸钠除杂时,反应的化学方程式分别为
②氢氧化钠和碳酸钠如果添加过量了,可在滤液中加入适量 溶液除去。
③“后续处理”的主要操作是蒸发,为了获得纯净的硫酸钠,应蒸发至 (填序号)。
A.完全蒸干时停止加热
B.快干时停止加热,利用余热蒸干
C.有大量固体析出时停止加热,过滤弃去剩余的少量溶液
④已知硫酸钠的溶解度随温度变化的曲线如图所示。40℃时,硫酸钠的溶解度为 g。将该饱和溶液升高温度至90℃,观察到的现象是 。

下图是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点。据图回答:

(1)P点的含义是
(2)t2℃时a、b、c三种物质的溶解度由大到小的排列顺序
(3)欲将t2℃时C物质的饱和溶液变为不饱和溶液,可采用的方法是 、 ;
(4) t2℃时将30g a物质加入到50g水中充分溶解,所得溶液是 (填“饱和”或“不饱和”),溶质质量分数是 。
(5)将t1℃时a、b、c三种物质的饱和溶液分别升温到t2℃,三种溶液的溶质质量分数大小关系是 。
| A.b>a=c | B.a=b>c | C.a>b>c | D.b>a>c |
(6)t2℃时,将a、b两物质的饱和溶液各100g,分别降温到t1℃,所得a物质溶液的质量 b物质溶液的质量(选填“>”或“=”或 “<”)
(7)t1℃时,a物质进行以下实验:
加1.5ga 再加1.5ga 升温至t2℃
10ml水 溶液X
溶液X 溶液Y
溶液Y 溶液Z
溶液Z
则所得溶液x、y、z中,为饱和溶液的是 。
(8)除去a固体中混有的少量固体b,提纯的步骤是:加水溶解、 、 ,然后过滤、洗涤、干燥。
试题篮
()