粗盐提纯是初中化学的基础实验之一。
(1)粗盐提纯的实验基本操作步骤为 。
(2)下列仪器中,①仪器G的名称是 ;②粗盐提纯实验中不会用到的仪器(填字母)是 。

(3)经上述操作得到的产品中仍可能含有可溶性的硫酸盐,要检验硫酸盐的存在,其操作为:取少量产品溶于水,并加入过量稀盐酸,再滴加试剂(填化学式) 溶液,观察是否有沉淀产生。
某化学兴趣小组在探究“复分解反应发生的条件”时,选做了如图1所示的三个实验:(提示:BaCl2溶液呈中性,Na2CO3溶液呈碱性。)

祺祺:向试管I中慢慢滴入MgCl2溶液,并不断振荡,至溶液颜色恰好变为无色为止。请写出该反应的化学方程式 。
雯雯:分别完成试管II和I中的两个实验后,接着进行如图2探究,请分析后作答:

(1)雯雯经过分析推断,试管Ⅲ反应后所得溶液中一定含有的溶质是 ;步骤①中一定发生的反应的化学方程式是 。
(2)祺祺把沉淀M、N混合后加入AgNO3溶液和过量的稀硝酸,观察到的实验现象是 ;实验结束,祺祺把反应后的混合物与滤液C全部倒入废液缸中,则废液缸内上层清液中,除酚酞外一定含有的溶质有 。
矿物资源的综合利用,可以节约资源与能源.黄铁矿的主要成分为二硫化亚铁(FeS 2),黄铁矿煅烧的化学方程式:4FeS 2+11O 2═2Fe 2O 3+8SO 2.产生的SO 2用于生产硫酸,矿渣(含有少量的硫元素)用于冶铁.
查阅资料:SO 2气体能使品红溶液褪色,能使澄清石灰水变浑浊,反应的化学方程式为SO 2+Ca(OH) 2═CaSO 3↓+H 2O.
(1)FeS 2中硫元素的化合价为 .矿渣在炼铁高炉内反应产生的高炉气含CO、CO 2、SO 2等气体,其中 是形成酸雨的气体.
(2)某化学兴趣小组为检验高炉气中的CO、CO 2、SO 2,设计了如图所示装置(不考虑其他气体对该实验的影响).
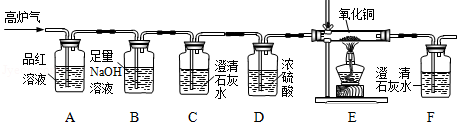
①该装置不能检验出的气体是 .
②装置B的作用是 .
③装置E中发生反应的化学方程式为 .
④确认高炉气中含CO的依据是 (填小写字母).
a.装置C中澄清石灰水变浑浊 b.装置C中澄清石灰水不变浑浊
c.装置E中黑色粉末变成红色 d.装置F中澄清石灰水变浑浊
(3)请指出该装置存在的一处明显缺陷 .
化学学科实践活动课上,老师拿来一包粉末。它是由长期放置在空气中的铁粉和久置的碱石灰干燥剂混合而成,让同学们设计实验进行探究。
【提出问题】固体样品的成分是什么?
【查阅资料】(1)碱石灰干燥剂是CaO和NaOH的混合物。
(2)BaCl2溶液显中性。
【猜想与假设】固体样品中可能含有Fe、Fe2O3、CaO、NaOH、Ca(OH)2、Na2CO3和 等七种物质。
【进行实验】
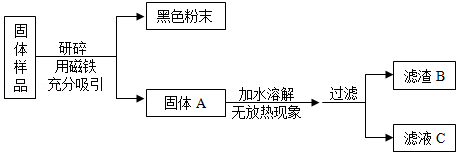
甲组同学对滤渣B的成分进行探究,记录如下:
实验操作 |
实验现象 |
实验结论及化学方程式 |
取少量滤渣B于试管中,加入足量稀盐酸,将生成的气体通入澄清的石灰水中 |
① ② |
结论:滤渣B中有Fe2O3,CaCO3.实验操作中反应的化学方程式为: (答出一个即可) |
乙组同学对滤液C的成分进行探究,记录如下:
实验操作 |
实验现象 |
实验结论 |
取少量滤液C于试管中,加入过量BaCl2溶液,静置,向上层清液中滴加无色酚酞试液,振荡 |
①有白色沉淀生成 ②酚酞试液由无色变成红色 |
滤液C中有 |
【解释与结论】(1)乙组同学实验中加入过量BaCl2溶液的目的是 。
(2)通过以上实验探究,该固体样品中能确定一定含有的成分是 。
氢氧化钠和氢氧化钙是两种常见的碱,化学实验活动课上,同学们进行了如图所示的实验。

(1)实验一中,B试管中发生反应的化学方程式为 。
A、B两支试管中共同的实验现象是 。
(2)实验二中,C试管中有白色沉淀生成,该白色沉淀是 (填化学式)。D试管中无现象,为了探究通入二氧化碳后D试管中溶质的成分,同学们进行了如下探究。
【提出猜想】猜想1:溶质是NaOH。
猜想2:溶质是NaOH和Na2CO3
猜想3:溶质是Na2CO3
实验操作 |
实验现象 |
实验结论 |
①取D中少量溶液于试管中加入过量稀盐酸 |
|
猜想1不成立 |
②取D中少量溶液于另一试管中,加入过量的Ca(OH)2溶液,过滤,取滤液加入酚酞溶液 |
产生白色沉淀, 酚酞溶液变红 |
猜想2成立 |
【反思与评价】I.小军评价实验操作②中加入Ca(OH)2溶液不正确,理由是 。
若要验证猜想2成立,需将Ca(OH)2溶液换成 溶液。
Ⅱ在实验室中氢氧化钠固体密封保存的原因是 (用文字叙述)
在“粗盐中难溶性杂质的去除”的实验课上,同学们制得了“白色的盐”,小刚很高兴,并大声地说:“我制得了纯净的NaCl。”老师否定了他的说法,并解释说:“同学们制得的白色的盐中除了含有NaCl外,还含有MgCl2、CaCl2、Na2SO4等可溶性杂质。”于是,同学们为了得到更纯的NaCl,设计了如下的实验方案:
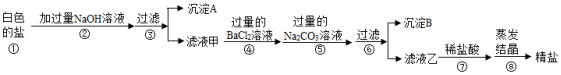
请回答下列问题:
(1)沉淀A的化学式是 。
(2)若将步骤④和⑤顺序颠倒会引发的后果是 。
(3)沉淀B中除了含有CaCO3以外还含有 。(填化学式)
(4)滤液乙中含有的阴离子是 。(填离子符号)
(5)小刚向滤液乙中,滴入几滴稀盐酸后就进行蒸发操作。丽丽马上制止,并设计实验,探究蒸发皿内溶液中除了NaCl以外,是否还含有其他溶质。于是,取少量该溶液于试管中,接下来进行的操作是 ,观察到的现象是 。
由此得出该溶液中溶质成分为NaCl和Na2CO3.如果用该溶液蒸发结晶,则得不到更纯的NaCl。
请根据图所示实验回答问题。

(1)根据探究酸与碱中和反应的实验回答:
当观察到溶液 时,可以确定氢氧化钠和盐酸发生了中和反应。滴加稀盐酸时,用玻璃棒不断搅拌的目的是 。
(2)根据测定空气里氧气含量的实验回答
①由该实验可得出的结论是 。
②若实验所用红磷量不足,会使测量结果 (填“偏大”“偏小”或“不变”)。
③实验中不能用铁丝代替红磷来测定空气里氧气的含量,原因是 。
中和反应在工农业生产和生活中有广泛的应用。某化学实验小组的同学对酸碱中和反应进行了如下研究。
【实验过程1】对于没有明显实验现象的中和反应,如稀盐酸与稀氢氧化钠溶液的反 应,要证明它们之间确实发生了化学反应,可通过如图所示实验步骤进行操作。

请根据上图所示实验步骤填写实验报告:
实验步骤 |
实验现象 |
实验结论 |
①向试管中加入1~2ml稀氢氧化钠溶液 |
|
NaOH与HCl 发生了中和反应 |
② |
|
|
③ |
|
【实验过程2】对于某些有明显现象产生的中和反应,如稀盐酸与氢氧化铝的反应,观察到有 的现象,就可以说明中和反应已经发生。该反应的化学方程式为 。[提 示:氢氧化铝是不溶于水的白色固体,其化学式为Al(OH)3]
【实验反思】
(1)有同学提出也可以使用石蕊溶液代替酚酞溶液进行【实验过程1】的实验。你认为 (填“酚酞溶液”或“石蕊溶液”)更适合用于验证稀盐酸与稀氢氧化钠溶液发生中和反应,你的理由是 。
(2)对于没有明显现象出现的酸碱中和反应,我们可以借助 的变化,来判断是否反应或反应进行的程度。
为验证氢氧化钠与盐酸反应,化学小组同学用各自实验台上提供的药品做了如图所示的实验。
(1)甲组同学向滴有酚酞溶液的稀盐酸中滴加NaOH溶液,振荡后溶液仍为无色,此现象 (填“能”或“不能”)证明氢氧化钠与盐酸发生了反应。
(2)乙组同学进行实验时,发现试管中出现了“怪现象”﹣有气泡产生。同学们通过讨论一致认为乙组同学所用的NaOH溶液已变质,写出产生气泡的化学方程式 。
【提出问题】变质的NaOH溶液中含有哪些溶质?
【作出猜想】猜想一: ;
猜想二:NaOH、Na2CO3
查阅资料】CaCl2溶液显中性。
【进行实验】
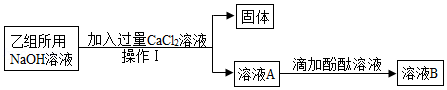
①操作I的名称是
②滴加酚酞溶液后的现象为 ,证明猜想二成立。
③小丹同学用CuSO4溶液代替酚酞溶液也证明了猜想二成立,写出此反应的化学方程式
【反思交流】实验室的化学药品应密封保存。
某化学兴趣小组做粗盐中难溶性杂质去除的实验,实验过程如图所示。

(1)步骤①的名称是 。
(2)步骤②中,玻璃棒的作用是 。
(3)步骤③中,当观察到蒸发皿内出现 时,停止加热。
(4)将氯化钠与泥沙分离所采用的方法,利用了氯化钠具有 的性质。
根据表中信息,请回答下列问题:
部分碱、酸、盐的溶解性表(20℃)
| 阴离子 阳离子 |
OH ﹣ |
NO 3 ﹣ |
Cl ﹣ |
SO 4 2 ﹣ |
CO 3 2 ﹣ |
PO 4 3 ﹣ |
| H + |
|
溶、挥 |
溶、挥 |
溶 |
溶、挥 |
溶 |
| K + |
溶 |
溶 |
溶 |
溶 |
溶 |
溶 |
| Na + |
溶 |
溶 |
溶 |
溶 |
溶 |
溶溶 |
| Ba 2+ |
溶 |
溶 |
溶 |
不 |
不 |
不 |
| Ca 2+ |
微 |
溶 |
溶 |
微 |
不 |
不 |
| Cu 2+ |
不 |
溶 |
溶 |
溶 |
﹣ |
不 |
说明:"溶"表示那种物质可溶于水,"不"表示不溶于水,"微"表示微溶于水,"挥"表示挥发性,"﹣"表示那种物质不存在或遇到水就分解了。
(1)CaCO 3属于 (填"可溶物"、"微溶物"或"不溶物")。
(2)表中可溶于水的硫酸盐有 种。
(3)在溶液中,磷酸钠与氯化钙能否发生复分解反应。若能,写出化学方程式;若不能,说明理由。
(4)某同学将盐酸倒入Ba(OH) 2溶液中,得到溶液甲。
①溶液甲中溶质的组成情况可能有 种。
②实验设计:探究溶液甲中可能含有的溶质
a.探究溶液甲中是否含盐酸
| 方案编号 |
实验操作 |
实验现象 |
| 1 |
取少量溶液甲于试管中,加入铁粉 |
是否 |
b.探究溶液甲中是否含Ba(OH) 2
| 方案编号 |
实验操作 |
实验现象 |
| 2 |
取少量溶液甲于试管中,加入 溶液 |
是否产生蓝色沉淀 |
| 3 |
取少量溶液甲于试管中,加入Na 2SO 4溶液 |
是否产生白色沉淀 |
上述三个方案中有一个不合理,请指出不合理的方案编号并说明理由: 。
③欲从溶液甲中获得纯净的BaCl 2固体,应采取的简单操作是 。

某兴趣小组的同学在实验室做如下实验:小雯探究碳酸钠固体和稀盐酸之间的反应,请写出该反应的化学方程式: ;小棋探究H2SO4、NaOH、CuSO4、BaCl2四种溶液之间的反应。
实验完毕,小雯和小棋将试管中的剩余物都倒入同一大烧杯中,过滤后得到了沉淀A和无色滤液M,并接着进行如下探究:
(查阅资料:Na2SO4溶液呈中性,Na2CO3溶液呈碱性)
实验步骤 |
实验现象 |
实验结论 |
①向所得沉淀A中加入过量稀盐酸,充分反应: |
出现白色沉淀B 和蓝色溶液,没有气泡产生 |
自色沉淀B是 |
②取少量无色滤液M于试管中,滴入酚酞溶液; |
溶液不变色 |
则滤液M 中一定含有的溶质是 |
③取步骤②中溶液,加入适量Na2SO4溶液,充分反应: |
无明显现象 |
|
④另取少量无色滤液M于试管中,加入几粒锌粒; |
|
小棋分析后认为:步骤④中加入锌粒没有必要:滤液M中还可能存在其它成分。如果将步骤④中的锌粒换成另一种试剂,可确定该成分是否存在。请写出小棋用所选试剂鉴定可能存在成分的化学方程式: 。
某化学兴趣小组围绕“酸和碱的反应”,做了如图所示的两个实验。

(1)实验一:向CuSO4溶液中滴入NaOH溶液,观察到的现象为 ,该反应的化学方程式为 ,继续滴加稀盐酸,通过稀盐酸与 反应的现象,证明了酸和碱能发生反应。
(2)向NaOH溶液中滴入几滴酚酞溶液,振荡,继续加入稀盐酸,观察到溶液由 色变为无色,由此现象也证明了酸和碱能发生反应。
实验结束后,小组同学对实验二中试管内的无色溶液成分展开了讨论。
【提出问题】试管中无色溶液的溶质除酚酞外还有什么?
【猜想假设】猜想一:NaCl和HCl
猜想二:
【实验设计】若要证明猜想一成立,下列试剂中不能达到实验目的是 。
A.紫色石蕊溶液 B.Cu C.AgNO3 D.Na2CO3
【讨论交流】小莹同学认为滴入NaOH溶液,也能证明猜想一成立,你认为小莹同学的方案是否可行并说明理由 。
实验课上,老师知道某兴趣小组进行粗盐提纯的实验,邀请你帮助他们完成下面的实验报告。
【实验名称】粗盐的提纯
【查阅资料】
1.粗盐中含有泥沙及少量可溶性MgCl2、CaCl2、Na2SO4等杂质。
2.Ba(OH)2是一种易溶于水的强碱。
【主要玻璃仪器】量筒、烧杯、漏斗、玻璃棒、胶头滴管、酒精灯
【主要试剂】粗盐样品、稀盐酸、BaCl2溶液、NaOH溶液、Na2CO3溶液、蒸馏水
【实验过程】
步骤及目的 |
过程及说明 |
一、去除粗盐 中的泥沙 |
1.称取粗盐样品10.0g,用蒸馏水充分溶解 2.过滤去除泥沙得到溶液I 以上两步操作中均需要使用到玻璃棒,玻璃棒的作用分别是:溶解时: ;过滤时: 。 |
二、去除可溶 性杂质 |
将溶液I按如图流程图进行处理:
1、“加入过量氢氧化钠”时,发生反应的化学方程式是 。 2、过滤后,所得的滤渣成分有 种。 3、判断“稀盐酸适量”的方法是 。 |
三、获得产品 |
将溶液Ⅱ注入 (填仪器名称)中,蒸发结晶,观察到 ,停止加热,利用余热蒸干。装置完全冷却后,获得干燥的产品9.4g。 |
四、数据处理 |
该粗盐样品中氯化钠的质量分数是94% |
【结果与反思】
1.实验操作、试剂和装置均不存在问题,老师却指出该样品中氯化钠的质量分数不是94%,原因是 。
2.小明提出,如果步骤二中只调换“过量的NaOH溶液”与“过量的BaCl2溶液”的加入顺序,对除杂结果也不会产生影响,你 (填“同意”或“不同意”)小明的观点。
在介绍氢气的制法时,老师告诉同学们,铝丝与一种可以用铁制容器盛装的溶液反应,也会生成氢气。
【提出问题】与铝丝反应的是什么溶液?
【交流讨论】分析后,大家一致认为该溶液不是稀盐酸或稀硫酸,原因是 。
同学们决定进一步探究。老师为同学们提供了该溶液。
【查阅资料】含有不同金属离子的溶液在灼烧时会产生不同颜色的火焰
| 钠 |
钙 |
钾 |
| 黄色 |
砖红色 |
紫色(透过蓝色钴玻璃) |
【实验探究】
①小强取该溶液于试管中,向其中滴加紫色石蕊溶液,发现紫色石蕊溶液变蓝。
②小明用铂丝蘸取该溶液在酒精灯火焰上灼烧,观察到火焰呈黄色。
③有同学提出应向该溶液中滴加稀盐酸,小美取该溶液于试管中,向其中加入足量的稀盐酸后,没有看到明显现象,这样做是为了排除 (填离子符号)的干扰。
【实验结论】该溶液为 溶液。
【交流反思】
①老师告诉同学们,铝与该溶液反应除了生成氢气外,还生成了一种含有AlO 2 ﹣的盐,请写出该反应的化学方程式 。
②金属铝的化学性质较活泼,而生活中使用的铝制品却耐腐蚀,原因是 。
试题篮
()