选择下列部分实验操作可完成两个实验,甲实验为除去粗盐中难溶性的杂质,乙实验为配制溶质质量分数为10%的氯化钠溶液。下列说法正确的是( )
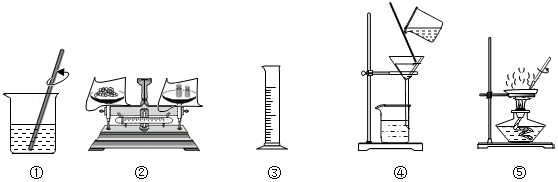
A.操作①和⑤中玻璃棒的作用是相同的
B.甲实验和乙实验都要用到的实验操作①
C.甲实验在操作⑤时,将水全部蒸发后停止加热
D.乙实验在操作③时,若俯视读数,会使所配制溶液的溶质质量分数偏小
粗盐中常含有MgCl2、CaCl2、Na2SO4及泥沙等杂质,常用下面的流程进行提纯。下列说法正确的是( )
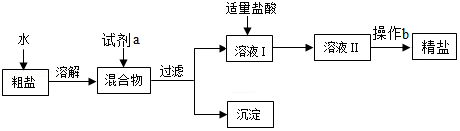
A.加入试剂a的顺序可以是过量的NaOH溶液、Na2CO3溶液,BaCl2溶液
B.加入试剂a后,将混合物过滤,得到的沉淀中除泥沙外还含有3种不溶物
C.向溶液Ⅰ中加入的盐酸也可以是过量的
D.操作b的名称为过滤
某粗盐样品中除含有不溶性固体杂质外,可能还含有少量氯化镁、氯化钙、硫酸钠.某化学兴趣小组开展如下探究活动:
探究一:除去粗盐中不溶性杂质
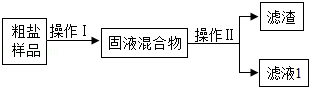
探究二:从滤液1中提取氯化钠固体(该探究中,微溶物不沉淀)
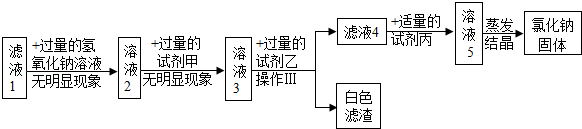
关于以上探究活动,有下列说法:
①试剂甲是碳酸钠溶液,试剂乙是氯化钡溶液
②滤液1中的溶质一定有氯化钠,可能有氯化钙
③若向探究二所得的白色滤渣中加入过量的稀盐酸,滤渣不溶解
④往滤液4中加入适量的试剂丙时有中和反应发生
上述说法中正确的是( )
A.①③B.①④C.②③D.②④
在"粗盐中难溶性杂质的去除"实验中,玻璃棒的用途不正确的是( )
| A. |
称取粗盐后,把粗盐研磨细 |
| B. |
溶解时搅拌,加速粗盐溶解 |
| C. |
称量精盐前,把精盐固体转移到纸上 |
| D. |
蒸发时搅拌,防止因局部温度过高,造成液滴飞溅 |
在“粗盐中难溶性杂质的去除”的实验课上,同学们制得了“白色的盐”,小刚很高兴,并大声地说:“我制得了纯净的NaCl。”老师否定了他的说法,并解释说:“同学们制得的白色的盐中除了含有NaCl外,还含有MgCl2、CaCl2、Na2SO4等可溶性杂质。”于是,同学们为了得到更纯的NaCl,设计了如下的实验方案:
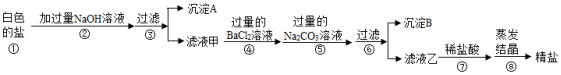
请回答下列问题:
(1)沉淀A的化学式是 。
(2)若将步骤④和⑤顺序颠倒会引发的后果是 。
(3)沉淀B中除了含有CaCO3以外还含有 。(填化学式)
(4)滤液乙中含有的阴离子是 。(填离子符号)
(5)小刚向滤液乙中,滴入几滴稀盐酸后就进行蒸发操作。丽丽马上制止,并设计实验,探究蒸发皿内溶液中除了NaCl以外,是否还含有其他溶质。于是,取少量该溶液于试管中,接下来进行的操作是 ,观察到的现象是 。
由此得出该溶液中溶质成分为NaCl和Na2CO3.如果用该溶液蒸发结晶,则得不到更纯的NaCl。
粗盐中含有泥沙等不溶性杂质,还含有氯化钙、氯化镁、硫酸钠等可溶性杂质。
提纯粗盐并制取纯碱的工艺流程如图:
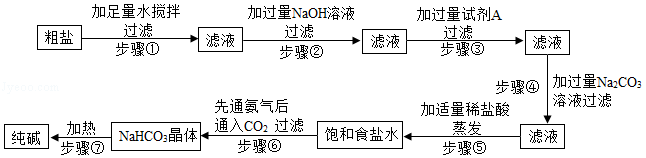
已知:①20℃时,将CO2通入含有NH3的饱和NaCl溶液中生成NaHCO3晶体和NH4Cl溶液
②20℃时,几种物质在水中的溶解度/g
NaCl |
NH4Cl |
NaHCO3 |
36.0 |
37.2 |
9.6 |
请根据上述题中有关信息,回答下列问题:
(1)步骤③中加入试剂A的化学式是 ;
(2)步骤④中加入过量Na2CO3溶液的目的是 ;
(3)在步骤⑥反应中,有NaHCO3晶体析出,而没有NH4Cl和NaCl析出的原因是 ;
(4)步骤⑦中NaHCO3转化为纯碱的化学反应方程式是2NaHCO3 Na2CO3+CO2↑+H2O,该化学反应属于 反应(填基本反应类型)。
小明在进行粗盐提纯和配制一定溶质质量分数的氯化钠溶液时,遇到了如下的问题,请你帮助小明来解答下列问题.
(1)粗盐提纯的步骤为:溶解、 、蒸发、计算产率.
(2)经过滤后,食盐水仍浑浊的可能原因是 (答一点即可).
(3)在蒸发实验操作中,当蒸发皿中出现 时停止加热.
(4)将配制好的氯化钠溶液,装入试剂瓶时不小心溅出,则剩余溶液中溶质的质量分数 (填“偏大”、“偏小”或“不变”).
学会物质的分离提纯和准确配制一定质量分数的溶液在实际应用中有重要意义。
实验一:粗盐提纯

(1)操作①中玻璃棒的作用是 ,操作③的名称为 ;
实验二:溶液配制
(2)用氯化钠固体配制100g质量分数为5%的氯化钠溶液,需要氯化钠 g;
(3)生理盐水可用于补充人体所需电解质,生理盐水中的溶质为 。
请回答下列实验问题:
(1)现提供下列装置:

①如图E装置中,甲仪器的名称是 。
②实验室用KClO3和MnO2混合制O2,发生装置可选用 (填装置序号),用装置C干燥O2,气体由导管 端(填“a”或“b”)进入,用E装置收集O2的依据是 。
③英国化学家布莱克是第一个“捕捉”到CO2的人,实验室制备CO2的化学方程式为 ;1774年德国化学家贝格曼将CO2通入紫色石蕊试液中,发现试液由紫色变为红色,此反应的化学方程式为 。
(2)对一定质量的粗盐(含泥沙)进行初步提纯。
①实验的主要步骤:称量与溶解、过滤、蒸发;蒸发结束后用 (填仪器名称)将固体从蒸发皿转移到纸片上,比较食盐提纯前后的状态。
②下列有关蒸发过程说法正确的是 (填序号)。
a.蒸发时用玻璃棒不断搅拌
b.当蒸发皿中水分全部蒸干时,停止加热
c.蒸发时若有滤液溅出,则精盐质量将偏低
d.蒸发过程中,溶液中钠元素质量增大
通过海水晒盐可得到粗盐。化学兴趣小组为了除去粗盐中难溶性杂质,进行了如图操作:

(1)上述操作的正确顺序是 (填序号)。
(2)下列情况可能导致精盐产率偏低的是 (填字母代号)。
A.溶解时加入的水过少导致粗盐未溶完
B.过滤时漏斗内液面超过滤纸边缘
C.蒸发时有液体飞溅
D.所得精盐中含有少量水分
海洋是一个巨大的资源宝库。海水资源综合利用的部分途径如图。
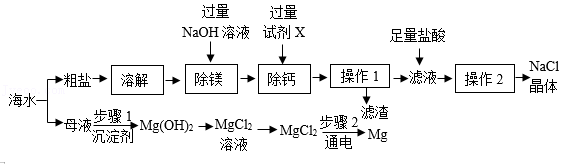
已知:粗盐中的杂质有泥沙、MgCl2、CaCl2,流程中部分操作及试剂已省略。
(1)试剂X的作用是除去粗盐中的Ca2+,则试剂X为 (填化学式)。
(2)“操作1”中玻璃棒的作用是 ,“操作2”的名称为 。
(3)滤渣中除泥沙外,还含有 。
(4)实际生产中,步骤1常选用 作为沉淀剂。
(5)步骤2需电解 状态的MgCl2以获得金属镁。
为除去粗盐中混有的泥沙,某学习小组按以下步骤进行实验:(实验环境温度为20℃)
Ⅰ.称量与溶解Ⅱ.过滤Ⅲ. 。
请回答下列问题:
(1)将步骤Ⅲ补充完整。
(2)如图中图1为氯化钠的溶解度曲线,图2为步骤Ⅰ中的部分操作:

①由图1给出的信息可知:20℃时,NaCl的溶解度是 g。
②从节约能源和提高产率的角度分析,图2中所需水的最佳体积是 mL.(提示:水的密度为1g•mL﹣1;产率 100%)
③用玻璃棒搅拌的目的是 。
(3)过滤时,若漏斗中的液面高于滤纸的边缘,造成的后果是 (填字母)。
a.过滤速度慢
b.滤纸破损
c.部分杂质未经过滤进入滤液
某同学为除去食盐水中的Na2SO4杂质,进行了以下实验:
下列有关说法错误的是( )
A.X为BaCl2溶液B.Y为Na2CO3
C.Z为稀盐酸D.步骤②与④可交换
为除去粗盐中含有的氯化镁、硫酸钠、氯化钙等杂质,应加入过量的氢氧化钠、氯化钡、碳酸钠等物质,将杂质转化为沉淀。过滤去除沉淀后,再向滤液中加入适量的盐酸得到精盐水。实验操作过程如图所示:

下列说法错误的是( )
A.实验操作步骤也可以是①③④②⑤⑥
B.操作⑥中,加入盐酸的目的是除去过量的氢氧化钠和碳酸钠,将滤液的pH调为7
C.在实验操作过程中,氯化钡和碳酸钠溶液的添加顺序可以颠倒
D.操作⑤得到的沉淀中共有四种物质
试题篮
()