学会物质的分离提纯和准确配制一定质量分数的溶液在实际应用中有重要意义。
(已知:20℃氯化钠的溶解度为36g,水的密度可近似看作1g/mL)
实验一:溶液配制
(1)用氯化钠固体配制100g质量分数为5%的氯化钠溶液。需要氯化钠 g,水 mL。
(2)0.9%的医用氯化钠溶液俗称生理盐水,可用于补充人体所需电解质。生理盐水中的溶质为 。
实验二:粗盐提纯

(3)操作①中玻璃棒的作用是 ,操作②的名称为 。
(4)20℃时提纯9g粗盐,若已知粗盐中氯化钠含量约为80%,溶解时应选择哪一种规格的量筒量取所需要的水最为合适(提供的量筒规格有“10mL“”、“25mL”和“100mL”),请你选择并说明理由 。
(5)提纯后的精盐属于 (填“纯净物”或“混合物”)。
某小组提纯含有泥沙的粗盐,并用提纯后的氯化钠来配制100g质量分数为7.5%的NaCl溶液。
(1)粗盐提纯:
①将粗盐加入到盛有水的烧杯里,使用玻璃棒搅拌,作用是
②在蒸发结晶的过程中,当蒸发皿中 停止加热。
(2)配制溶液:
③配制上述溶液需要称取提纯后的精盐 g;
④量取所需的水应选用 mL的量筒。
除去NaCl溶液中CaCl2、MgCl2、Na2SO4杂质的操作有:①溶解;②依次加过量的BaCl2、NaOH、Na2CO3溶液;③过滤;④加适量的盐酸;⑤蒸发结晶。
(1)过滤后滤液中的溶质有 种,过滤中玻璃棒的作用是 。
(2)加盐酸后反应的化学方程式为 。(写出一个即可)
为除去粗盐中的CaCl2、MgCl2、Na2SO4等可溶性杂质,进行了如下操作:①溶解;②依次加过量的BaCl2、NaOH、Na2CO3溶液;③过滤;④加适量盐酸;⑤蒸发结晶。加入Na2CO3溶液的作用是 ;操作③得到固体的成分有CaCO3、BaCO3和 ;操作④中测定溶液的酸碱度可以使用 。
化学与人类的生产生活密切相关,已为人类的进步作出了巨大的贡献。请用所学的化学知识回答下列问题。
(1)生活中常接触到"加碘食盐","高钙牛奶",其中的"碘"和"钙"应理解为 (填编号)。
A元素 B.原子 C.单质
(2)糖类物质是人体能量的主要来源,其中最基本的糖类物质是葡萄糖,其化学式为 。当血液中的葡萄糖浓度过低时,人会产生头晕、心悸等低血糖症状,因此我们每天去合理摄入糖类物质。
(3)"84"消毒液是一种常用的消毒剂,其主要成分是次氯酸钠(NaClO),制取它的方程式为2NaOH+Cl 2=NaClO+X+H 2O,则X的化学式为
(4)不法分子,常用铜锌合金假冒黄金行骗,请你写出一种鉴别真假黄金的化学方法:
(5)某工厂用粗盐配制的氯化钠溶液中,经分析发现含有少量的氯化钙杂质,请你写出,除去该杂质的化学方程式: 。
请从A或B两题中任选一个作答,若两题均作答,按35﹣A计分.
| A用浓硫酸配制100g 9.8%的稀硫酸 |
B粗盐中难溶性杂质的去除 |
| (1)实验需要5.4mL浓硫酸和90mL水.量取两种液体用到的仪器有 (填序号). (2)稀释时,需将浓硫酸缓慢倒入水中,并不断进行搅拌,其原因是 . |
(1)过滤需要用到的仪器有 (填序号). (2)蒸发过程中,需不断进行搅拌,其原因是 . |
| 可供选择的主要仪器: ①试管 ②烧杯 ③蒸发皿 ④托盘天平 ⑤10mL量筒 ⑥100mL量筒 ⑦药匙 ⑧胶头滴管 ⑨漏斗 ⑩酒精灯⑪铁架台⑫玻璃棒 |
|
| |
|
通过海水晾晒可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是制备精盐水的实验方案,各步操作流程如图:

(1)在第①步粗盐“溶解”操作中,玻璃棒的作用是 。
(2)第③步操作的目的是除去粗盐中的 (填化学式)。
(3)第④步操作的目的是除去混合液中的 (填化学式)。
(4)第③步操作与第④步操作的顺序能否交换 (填“能”或“否”)。
水是生命之源,也是一种重要的资源,日常生活、工农业生产和科学实验都离不开水,请回答下列问题:
(1)自然界的水一般都不是 (填"纯净物"或"混合物")含有较多可溶性钙、镁化合物的水叫硬水,生活中一般采用 的方法把硬水转化为软水.
(2)为了除去粗盐中的Ca 2+、Mg 2+、SO 4 2 ﹣等,可将粗盐溶于水,再进行如下操作:①加入适量稀盐酸 ②加入过量NaOH溶液 ③加入过量Na 2CO 3溶液 ④加入过量BaCl 2溶液 ⑤过滤 ⑥蒸发结晶,请将上述操作按合理顺序补充完整:② ⑥(填序号)
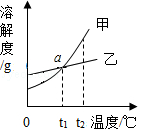
(3)如图是甲、乙两种固体物质(甲、乙均不含结晶水)在水中的溶解度曲线图.
①a点表示的意义是 .
②将t 1℃时甲、乙两物质的饱和溶液升温到t 2℃,其溶液中溶质质量分数大小关系是甲 __ 乙.(填">"、"<"或"=")
(4)化学实验中,水除了用于溶解物质外,你还知道水的用途有 (答一种即可)
除去粗盐中难溶性杂质后,得到的固体中除了NaCl还含有少量的可溶性杂质MgCl 2、CaCl 2,某同学为除去可溶性杂质,将该固体加水溶解形成溶液A,并设计如下方案 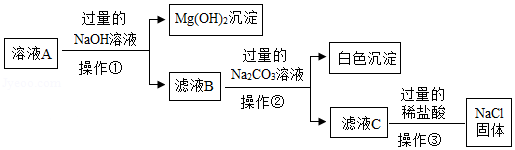
(1)操作①、操作②指的是 ;
(2)滤液B中的溶质是 ;
(3)操作③中加过量的稀盐酸是为了除去溶液中的 (填序号);
①NaOH ②Na 2CO 3③MgCl 2 ④CaCl 2
生活由处处有化学,请根据所学知识回答下列问题:
(1)端午节是我们的传统节日,某种粽子使用糯米、火腿瘦肉、食盐和少量油为原料,你认为还缺少的营养素为 (除水以外);
(2)山药中含有碱性皂角素,皮肤沾上会奇痒难耐,你认为可涂厨房中的 (调味品)来止痒,请再列举一个与此原理相同的实例 ;
(3)某食品包中的白色干燥剂是 (写俗称),其干燥的原理为(用化学方程式表示) ;
(4)净水时用 来吸附水中色素和异味,生活中用 (操作名称)降低水的硬度;
(5)除去粗盐中难溶性杂质的实验操作步骤为①溶解② ③蒸发④计算产率。
(1)如图所示为x、y、z三种固体物质(不含结晶水)的溶解度曲线,请回答下列问题:
① ℃时,物质x与物质z的溶解度相等;
②当x中含有少量y时,应采用 (填“降温结晶”或“蒸发结晶”)的方法提纯x;
③t3℃时将等质量x、y、z的饱和溶液降温到t2℃时,所得溶液中溶剂质量由小到大的顺序是 ;
④t3℃时将溶质质量分数为25%的x溶液降温至t1℃,所得溶液的溶质质量分数是 。
(2)在粗盐提纯时通常需要①溶解 ②依次加入过量的BaCl2溶液、NaOH溶液、Na2CO3 浴液③过滤④加入足量稀盐酸⑤蒸发结晶等操作来除去粗盐中的Na2SO4、MgCl2、CaCl2杂质以达到提纯的目的。
a.上述步骤①③⑤中都会用到的一种玻璃仪器是 ;
b,提纯的上述操作中共发生 个复分解反应。

从海水中可制备纯碱和金属镁,其流程如图所示.

(1)粗盐提纯时,每步操作都会用到的一种玻璃仪器是 .(填仪器名称)
(2)粗盐水中主要含有CaCl2、MgSO4等可溶性杂质,可加入下列物质:a.适量的盐酸;b.稍过量的Na2CO3溶液;c.稍过量的Ba(OH)2溶液,利用过滤等操作进行除杂,则加入这三种物质的先后顺序为 .(填字母序号)
(3)向饱和的氯化钠溶液中通入氨气和二氧化碳,经过一系列变化,最终可得到纯碱.请写出第Ⅲ步反应的化学方程式 .
(4)第Ⅴ步Mg(OH)2与盐酸的反应 中和反应.(选填“是”或“不是”)
Ⅰ.如图是同学们做粗盐提纯的部分实验示意图,请回答下列问题:

(1)粗盐提纯实验操作顺序为称量、 (填序号)以及称量、计算产率.
(2)过滤适合 混合物的分离.
Ⅱ.某同学欲配制50g5%的氯化钠溶液,计算出所需氯化钠的质量和水的体积.用 称量氯化钠质量,倒入烧杯中,用规格为 mL的量筒量取所需水的体积,溶解,装瓶备用.
试题篮
()