乙醇(C2H5OH)俗称酒精,可用作酒精灯、内燃机等的燃料。
(1)燃着的酒精灯用灯帽盖灭,是破坏了 这一燃烧条件。
(2)现有10.0g质量分数为92.0%的酒精的水溶液,在充满足量氧气的密闭容器里充分燃烧后,冷却至室温,求密闭容器内水的质量(结果精确到0.1g)。
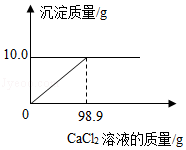
称取NaCl和Na2CO3的固体混合物11.1g,加入100.0g水配成溶液后,向其中逐渐加入一定浓度的CaCl2溶液。所加CaCl2溶液的质量与生成沉淀的质量关系如图所示。(提示:Na2CO3+CaCl2═CaCO3↓+2NaCl)
(1)恰好完全反应时生成CaCO3的质量是 g。
(2)当恰好完全反应时,计算所得溶液中溶质的质量分数。(写出计算过程)
(1)麦芽糖的化学式是C12H22O11,则每个麦芽糖分子中氢、氧原子的最简个数比为 ,麦芽糖中碳、氢、氧三种元素的质量比为 (填最简整数比)。
(2)鸡蛋壳中的主要成分是碳酸钙,小华为检测鸡蛋壳中碳酸钙的含量,进行的实验及实验数据如图所示。请回答下列问题:
(信息:鸡蛋壳中其他成分与稀盐酸接触不产生气体。)

①根据质量守恒定律可知,完全反应生成气体的质量为 g。
②计算鸡蛋壳中碳酸钙的质量分数。(写出计算过程,精确到0.1%)
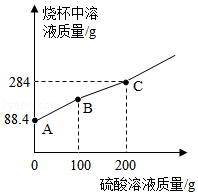
现有盛88.4g Na2CO3和NaOH混合溶液的大烧杯,向其中滴加质量分数为9.8%的H2SO4溶液,充分搅拌,烧杯中溶液的质量与滴加H2SO4溶液的质量关系如图所示,回答下列问题:
(1)写出AB段发生反应的化学方程式 。
(2)BC段可以观察到大烧杯的溶液中有气泡产生,则生成气体的质量为 g。
(3)B点时,大烧杯中的溶液pH 7(填“>”、“=”或“<”)。
(4)C点时,所得溶液为不饱和溶液。求溶液中溶质的质量分数。(写出计算过程)
将12.5g混有二氧化锰的氯酸钾固体加热至质量不再减少,冷却后称量固体的质量为7.7g。
(1)反应时生成氧气的质量为 g。
(2)计算反应前固体中二氧化锰的质量分数(要求写出计算过程)。
碳还原氧化铜的实验装置如图甲、乙所示。甲图中酒精灯上网罩的作用是 。
[提出问题]碳燃烧时可能生成CO 2也可能生成CO,那么碳与氧化铜反应生成的气体是否也有多种可能?
[作出猜想]猜想Ⅰ:CO;猜想Ⅱ:CO 2;猜想Ⅲ: 。
[设计方案]实验装置如图乙所示。打开K,缓缓通入干燥的氮气一段时间,关闭K,点燃酒精喷灯和酒精灯,充分反应后,熄灭酒精喷灯和酒精灯,打开K,再通入一段时间氮气。
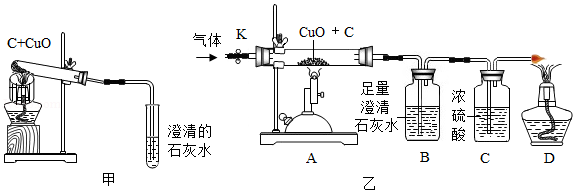
方案一:从定性观察角度判断
(1)实验时装置A处的现象是 。
(2)若B中无明显现象,D处的气体能点燃,则猜想 (填序号)成立。
方案二:从定量计算角度判断
取一定量碳粉和4g氧化铜的混合物进行实验,并测定表格中的四个数据:
| |
反应前的质量 |
反应后的质量 |
| A(玻璃管+固体) |
m 1 |
m 2 |
| B+C(广口瓶+混合液) |
m 3 |
m 4 |
(3)若猜想Ⅱ成立,则理论上(m 4﹣m 3) (m 1﹣m 2)(填">""<"或"=")。
(4)若猜想Ⅲ成立且CuO全部转化成Cu,则参加反应的碳粉的质量m的取值范围是 [交流反思]实验开始前缓缓通入氮气的目的是 。
如图2为某钙片的商品标签,为测定钙片中钙元素的质量分数(假设钙片中其他物质不含钙元素,且不溶于水,也不与任何物质发生反应),某化学兴趣小组取20片钙片,进行如下实验:

(1)上述实验过程中发生反应的化学方程式为 。
(2)根据已知条件列出求解所加的稀盐酸中溶质质量(x)的比例式 。
(3)用36.5%的浓盐酸配制100g上述稀盐酸,所需浓盐酸的质量为 。
(4)钙片中钙元素的质量分数为 。
(5)若向滤液中加入5.4g水,所得溶液中溶质的质量分数为 。
(6)工厂生产钙片时若需碳酸钙120t,理论上需含氧化钙84%的生石灰的质量为 。
常温下,向盛有100.0g KOH溶液的烧杯中逐滴加入120.0g质量分数为7.3%的稀盐酸,用pH计(精确测定溶液pH的仪器)测定反应过程中溶液的pH,所得数据如表:
| 加入稀盐酸的质量/g |
60.0 |
80.0 |
100.0 |
120.0 |
| 烧杯中溶液的pH |
13.7 |
13.3 |
7.0 |
0.7 |
(1)恰好完全反应时,消耗稀盐酸的质量为 g。
(2)求该KOH溶液中溶质的质量分数(结果精确到0.1%)。
向盛一定质量铁粉的烧杯中逐滴加入稀硫酸充分反应,产生气体质量与所加稀硫酸质量的关系如图所示。请根据该图信息计算:
(1)铁粉反应完时,产生氢气的质量为 g。
(2)原稀硫酸中溶质的质量分数(写出计算过程)。

为了探究氢氧化钡溶液和硫酸钠溶液反应后所得滤液X的成分,同学们做了以下实验:取50克滤液于烧杯中,先向烧杯中滴加溶质质量分数为6%的硫酸镁溶液20克,接着向烧杯中滴加稀硫酸。加入溶液的质量与烧杯内沉淀的质量关系如图所示。
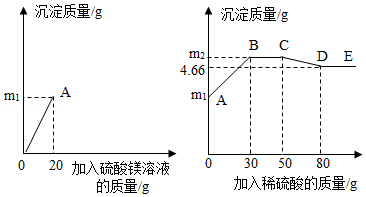
(1)滤液X的pH 7(选填"大于"、"等于"或"小于")
(2)CD段发生反应的化学方程式为 。
(3)滤液X中含有的溶质是 。
(4)滴加入30克稀硫酸时,烧杯中沉淀的质量m 2的值为多少?(写出计算过程)
水污染与防治是当今人类需要关注的环境问题之一,工农业废水和生活污水是水污染的主要来源。回答下列问题:
(1)酸雨 (填“能”或“不能”)污染水体,煤燃烧产生SO2,SO2形成酸雨的主要原因是 。
(2)废旧电池中含有的汞、镉等重金属会污染水体,造成生物体中毒,其原因是重金属能使生物体内的 (填化学物质)结构破坏,失去生理活性。
(3)某工业废水含HgSO4,可通过铁网而将汞留下,加热将汞形成蒸气回收利用。其反应的化学方程式为 ,汞的沸点 (填“低于”或“高于”)铁的沸点。也可以向废水中加入Na2S溶液形成沉淀而除去汞,该沉淀的化学式为 。
(4)甲厂污水含硫酸的质量分数为0.98%,其流速为45kg/s,乙厂污水含烧碱的质量分数为0.4%,为排放达标,现将两厂的污水混合处理,反应的化学方程式为 ,则乙厂污水的最佳流速为 kg/s。
某NaCl样品中混有杂质BaCl2,为测定样品中BaCl2的质量分数,取固体样品10.0克完全溶解于水中,并向其中逐滴加入稀硫酸,实验过程中,产生沉淀的质量与加入稀硫酸的质量关系如图所示
(1)沉淀的化学式 。
(2)计算样品中BaCl2的质量分数(写出计算过程)

氢氧化钠、氢氧化钙是两种常见的碱。
(1)它们有一些相似的化学性质,其原因是溶液中都含有 。
(2)可作某些气体干燥剂的是 。
(3)用氢氧化钙溶液检验二氧化碳,反应的化学方程式为 。
(4)根据化学方程式计算,用7.4kg氢氧化钙能中和硫酸厂排放的污水中硫酸的质量是多少?
往80g含有硝酸铜和硝酸银的混合溶液中加入一定量的镁粉,加入的镁粉的质量与溶液质量变化如图所示。试分析计算:
(1)a→b段表示镁粉与混合溶液中的 反应。(填化学式)
(2)原混合溶液中硝酸铜的质量分数是多少?(写出计算过程,精确到0.1%)

化学是一门实用的基础科学,在人类社会的发展历程中起着重要作用。
正确认识物质
人们在实验研究中总结出常见金属的活动性顺序:

(1)请在表中□内填写对应的元素符号。
(2)Mg、Sn、Pt、Au四种金属,能与稀盐酸(或稀硫酸)发生置换反应的金属有 种。
(3)Cu能从AgNO3溶液中置换出Ag,请说明理由: 。
合理利用资源
(1)工业上用含氧化铁480t的赤铁矿为原料炼铁,得到含杂质4%的生铁 t。
(2)化学小组通过实验将生锈铁钉回收处理。
[铁钉处理]
实验过程 |
实验现象 |
实验原理 |
保存方法 |
a.向盛有生锈铁钉的烧杯中加入稀盐酸,浸没铁钉 |
溶液由无色变为黄色、铁钉表面有气泡产生、铁锈脱落 |
请写出稀盐酸除铁锈的化学方程式:
|
写出一条防止铁制品生锈的方法:
|
b.取出铁钉,洗涤、干燥,妥善保管 |
铁钉呈现银白色 |
(3)小组同学提出,烧杯中的废液也可以回收处理。
[废液处理]
同学们查阅相关资料,获知:
a.Fe2O3是一种红棕色粉末,俗称铁红,常用作红色油漆和涂料。
b.FeCl2+2NaOH=Fe(OH)2↓+2NaCl
c.4Fe(OH)2+O2+2H2O=4Fe(OH)3
d.不溶性碱受热易分解,生成对应的金属氧化物和水。
实验流程:

①悬浊液A静置一天的原因是 。
②操作I是 。
③写出固体C转化为铁红的化学方程式 。
促进科技发展
化学学科在合成药物等方面发挥若巨大作用,以下是几种常见的合成药物,请根据信息回答下列问题:
(1)解热镇痛药
阿司匹林是人们熟知的治感冒药,具有解热镇痛作用,化学式为C9H8O4,相对分子质量是 。
(2)抗生素
青霉素是最重要的抗生素,即消炎药,能治疗肺炎和外伤感染等。青霉素中用得较多的是青霉素钠,化学式为C16H17O4N2SNa,其中氢、氧元素质量比为 。
(3)抗酸药
抗酸药是一类治疗胃痛的药物,能中和胃里过多的盐酸,缓解胃部不适。抗酸药的种类很多,通常含有一种或几种化学物质,如NaHCO3、MgCO3、Mg(OH)2等。请写出其中一个与盐酸反应的化学方程式 。
试题篮
()