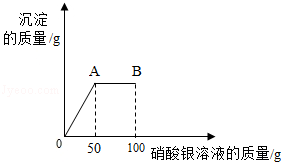
将1.17 g氯化钠固体放入烧杯中,加入51.7g水充分溶解后得到常温下氯化钠的不饱和溶液,再向所得溶液中逐滴滴入100 g一定溶质质量分数的硝酸银溶液。实验过程中生成沉淀的质量与滴入硝酸银溶液的质量关系如图所示:
(1)B点时,溶液中所含硝酸银的质量为 。
(2)A点时,所得溶液中溶质质量分数为多少?(计算结果精确到0.1%)
某碳酸钠样品中含有一定量的碳酸氢钠,为测定某纯度,取100g样品加热至不在产生气体(2NaHCO 3  Na 2CO 3+H 2O+CO 2↑),使生成的水完全被浓硫酸吸收,测得加热时间和浓硫酸质量增加的关系如下表:
Na 2CO 3+H 2O+CO 2↑),使生成的水完全被浓硫酸吸收,测得加热时间和浓硫酸质量增加的关系如下表:
| 时间(min) |
0 |
1 |
2 |
3 |
4 |
| 仪器和浓硫酸的质量总和(g) |
150 |
150.9 |
151.8 |
152.7 |
152.7 |
回答下列问题:
(1)当完全反应后,生成水的质量为 g。
(2)样品中碳酸氢钠的质量分数是多少?
(3)若将加热后所得固体完全溶解于300g水中,计算所得溶液中溶质的质量分数。
洁厕灵是常用的陶瓷清洗液,某同学对某品牌洁厕灵的有效成分含量进行探究。向一锥形瓶中加入100g该品牌的洁厕灵,再加入足量的溶质质量分数为8%的NaHCO3溶液120g,反应结束后溶液的总质量是215.6g。试计算下列问题:
[知识卡片]洁厕灵有效成分是HCl,洁厕灵中其它成分均不跟NaHCO3反应。
(1)产生的二氧化碳质量为 克。
(2)该品牌洁厕灵中HCl的质量分数是多少?(写出计算过程。)
向100g CuSO4与H2SO4的混合溶液中加入质量分数为20%的氢氧化钠溶液,产生沉淀的质量与所加氢氧化钠溶液的质量关系如图所示,回答下列问题:
(1)由图象可知,NaOH先与混合溶液中 发生反应。
(2)生成沉淀Cu(OH)2的质量是多少?
(3)当加入NaOH溶液的质量为40 g时,所得溶液中Na2SO4的质量分数是多少?(结果精确到0.1%)
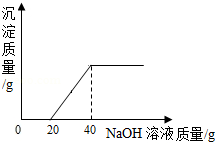
往100g硫酸和硫酸铜的混合液中,逐滴加入8%的氢氧化钠溶液直至过量,根据实验事实绘制了如图所示曲线,分析并计算:
(1)a→b段表示氢氧化钠与混合物中的 发生反应。
(2)求反应前混合液中硫酸铜的质量分数。(写出计算过程)

巴中某超市卖的纯碱(Na2CO3)产品往往含有少量的氯化钠(NaCl),化学兴趣小组的同学通过实验来测定该纯碱样品中纯碱的质量分数.他们取12g纯碱样品放入烧杯中,逐滴加入稀盐酸至不再产生气泡为止,共消耗盐酸100g,烧杯中没有残留不溶物,称得反应后溶液的质量为107.6g.计算:
(1)生成二氧化碳 g.
(2)样品中纯碱的质量分数是多少?(要求写出计算过程,结果精确到0.1%)
垃圾分类就是新时尚。目前,践行“新时尚”的垃圾分类工作已在全国地级及以上城市全面启动。
(1)生活垃圾可分为可回收垃圾、餐厨垃圾、有害垃圾等。
①空饮料瓶、废旧报纸应放置于贴有标志 (填字母序号,下同)的垃圾箱中。
②废旧电池中含有铅、镉、汞等有害金属,如果将其随意丢弃,这些金属渗出会造成土壤及 污染,威胁人类健康,应将其放入废旧电池专用收集箱。
③餐厨垃圾是生活垃圾的主要来源。下列有关说法合理的是 。
A.餐厨垃圾沥干水分后放入家用垃圾袋
B.部分餐厨垃圾可作为沼气池中发酵的原料
C.外出就餐提倡“光盘行动”
(2)垃圾是“放错了地方的资源”。
①部分废旧塑料具有 (选填“热塑”或“热固”)性,可反复加工再利用。
②某化学兴趣小组从工厂收集到一份金属废料,可能含有Al、Zn、Fe、Ag四种金属中的一种或几种,为测定其组成,便于回收利用,现取样向其中加入一定质量的CuSO4溶液。
Ⅰ.充分反应,得到无色溶液及少量固体剩余物,且反应前后溶液的质量相等。该金属废料中一定含有 (填元素符号)。
Ⅱ.将Ⅰ中少量固体剩余物置于试管中,加入足量稀盐酸充分反应, (选填“一定有”、“可能有”或“一定没有”) H2生成。
③建筑工地废弃的大理石边角料(主要成分为CaCO3,杂质不参加反应)可用于制备轻质碳酸钙(常用作牙膏中的摩擦剂)。已知:CaCO3 CaO+CO2↑

Ⅰ.操作a的具体步骤包括 、洗涤、干燥。
Ⅱ.计算10g大理石边角料理论上最多得到轻质碳酸钙的质量(写出计算过程)。

小嘉发现:向碳酸钠溶液中倾倒稀盐酸,很快就产生了气泡:向碳酸钠溶液中逐滴加入稀盐酸,滴加一定量后才有气泡产生。查阅资料:向碳酸钠溶液中逐滴加入稀盐酸,先发生的反应是Na2CO3+HCl═NaCl+NaHCO3;当Na2CO3全部转化成NaHCO3后,再发生反应NaHCO3+HCl═NaCl+H2O+CO2↑。为此他用如图所示装置进行了如下实验:
步骤一:在广口瓶中加入10克溶质质量分数为10.6%的碳酸钠溶液,用注射器向瓶中缓慢注入一定量的溶质质量分数为7.3%的稀盐酸,观察到瓶内无明显现象; 步骤二:继续用注射器向瓶中注入稀盐酸,一段时间后观察到瓶内连续产生气泡,烧杯中澄清石灰水?。 |
(1)步骤二中,观察到烧杯中澄清石灰水 。
(2)上述实验中,加入稀盐酸多少克后,才开始产生二氧化碳? 。
(3)向一定量碳酸钠溶液中无论是倾倒还是逐滴加入足量的稀盐酸,完全反应后产生二氧化碳质量是相同的,其本质原因是什么? 。

某兴趣小组在实验室发现盛有固体氢氧化钠的试剂瓶破裂瓶盖处有"白毛"状物质(如图),根据所学知识,他们推断"白毛"状固体物质中含有碳酸钠,依据是 。他们取5g白色固体,加水配成20g溶液倒入烧杯中,将40g氯化钡溶液分成四等份,分4次加入烧杯中,充分反应后测得数据如下表:
| 实验次数 |
1 |
2 |
3 |
4 |
| 加入氯化钡溶液的质量/g |
10 |
10 |
10 |
10 |
| 烧杯中所得溶液的质量/g |
28.03 |
36.06 |
44.09 |
54.09 |
(1)第 次实验,加入的氯化钡与碳酸钠恰好完全反应。
(2)求5g白色固体中碳酸钠的质量。(写出计算过程,结果保留两位小数)

实验室用含杂质的锌(也称粗锌)与盐酸反应制取氢气,取8.0g含杂质的锌粒于烧杯中(所含杂质不溶于水,也不与酸反应),向其中加入73.0g稀盐酸,恰好完全反应后烧杯内剩余物质的质量为80.8g。计算:
(1)生成氢气的质量 g。
(2)求稀盐酸的溶质质量分数(请写出计算过程)。
某炼钢厂每天需消耗5000t含Fe2O376%的赤铁矿,该厂理论上可日产含Fe 98%的生铁的质量是多少?
化学兴趣小组要测定制作叶脉书签所用氢氧化钠溶液的浓度。取40g该氢氧化钠溶液于锥形瓶中,加入数滴酚酞溶液后再滴加质量分数为10%的稀硫酸,当锥形瓶中液体由红色恰好变成无色时,消耗稀硫酸的质量为49g。试计算该氢氧化钠溶液中溶质的质量分数。
为测定某赤铁矿中Fe2O3的含量,取10g该赤铁矿样品于烧杯中,向其中加入100g稀盐酸,恰好完全反应,测得剩余固体的质量为2g。(杂质不溶于水也不与酸反应)
请完成下列分析及计算:
(1)10g样品中杂质的质量为 g。
(2)计算稀盐酸中溶质的质量分数。
钼是一种重要的金属,用它制成的合金有良好的机械性能,在工农业生产和国防上都有广泛的用途。如图是利用钼矿石(主要成分为MoS 2)制备金属钼的流程图:
信息:MoO 3+3H 2 Mo+3H 2O

请回答下列问题:
(1)反应①常将钼矿石粉碎,目的是 ;MoO 3中钼元素的化合价为 。
(2)操作Ⅰ的名称是 ;常用NaOH溶液吸收反应①的尾气,化学方程式为 。
(3)制得19.2吨金属钼,理论上至少需含MoO 380%的粗产品多少吨?请写出计算过程。
注:粗产品杂质中不含钼元素
某课外兴趣小组的同学取14g大理石样品(主要成分是CaCO3)于烧杯中,将50克稀盐酸分成5次加入到烧杯中充分反应(已知大理石样品中其余成分不溶于水,也不与稀盐酸反应),得到如下数据:
次数 |
第1次 |
第2次 |
第3次 |
第4次 |
第5次 |
加入稀盐酸的质量/g |
10 |
10 |
10 |
10 |
10 |
烧杯中剩余物的总质量/g |
22.8 |
31.6 |
40.4 |
49.6 |
59.6 |
试计算:
(1)实验过程中生成气体的总质量 g;
(2)实验最终所得溶液中CaCl2的质量分数(写出计算过程);
(3)第4次加入10g稀盐酸所产生气体的质量 g。
试题篮
()