向盛有10g纯碱样品(含有少量氯化钠)的烧杯中加入稀盐酸。加入80g稀盐酸时,恰好完全反应。反应后烧杯内物质总质量为86.7g。
(1)该反应生成二氧化碳的质量为 g;
(2)求该纯碱样品中碳酸钠质量分数(写出计算过程)。
镁在国产大飞机C﹣919”的制造中大显身手,小亮在实验室模拟“海水制镁”的原理来富集镁,他将25g氯化钠和氯化镁的固体混合物全部溶解于盛有70g水的烧杯中,然后向其中加入63.6g氢氧化钠溶液至恰好完全反应(图象如图),过滤,称量滤液质量为147g,求:
(1)图象中m= g。
(2)滤液中溶质的质量分数是多少?

造纸是我国古代四大发明之一,它极大地推动了人类文明的发展。
(1)践行“习近平生态文明思想”,应积极推广垃圾分类和回收利用。旧报纸应投放到贴有如图 (填字母)标签的垃圾筒内。

6105n,n为正整数]中H、O两种元素的质量比为 (用最简整数比表示)。
(3)造纸会产生大量含NaOH的废水,需处理至中性后排放。环保监测小组取某造纸厂废水样品过滤,为测定滤液中NaOH的质量分数,进行了如下实验:
步骤1:取20.0g滤液于锥形瓶中,滴入几滴酚酞溶液。
步骤2:向锥形瓶中逐滴滴加溶质质量分数为10.0%的硫酸溶液至溶液呈中性,此时溶液呈 色。消耗硫酸溶液3.92g。
计算废水滤液中NaOH的质量分数。(请写出计算过程)
碳及其氧化物性质的应用。
(1)如图所示,向盛有红棕色二氧化氮气体的集气瓶里投入几小块烘烤过的木炭,红棕色消失,说明木炭具有 能力,其原因是木炭具有 的结构。
(2)在书写具有保存价值的档案时,规定应使用碳素墨水,原因是 。
(3)将一定质量的金刚石在足量的氧气中充分燃烧,固体全部消失,写出反应的化学方程式 ;将生成的产物用足量的氢氧化钠溶液来充分吸收并测定其质量,当金刚石的质量恰好等于 时,则可证明金刚石是由碳元素组成的单质。
(4)在实验室里,检验二氧化碳一般用澄清石灰水,而吸收二氧化碳常用氢氧化钠溶液,理由是 。
(5)写出碳在高温时还原氧化铜的化学方程式,并计算要使80g氧化铜完全还原,需要碳的质量至少是多少?(在答题卡上写出计算过程)
对销售的化肥,国家有明确的质量要求。某兴趣小组对市售的某钾肥进行了检测,称取2.0g样品放入烧杯中,加入适量的水溶解后,逐滴加入10%的BaCl2溶液,产生沉淀的质量与所加入BaCl2溶液质量的关系如图1所示(假定杂质不参加反应)。
已知:K2SO4+BaCl2═BaSO4↓+2KC1。

(1)20.8g BaCl2溶液中所含溶质的质量为 g。
(2)通过计算,判断该钾肥中K2SO4的质量分数是否符合图2的包装说明?(写出计算过程)
氯化钠是重要的化工原料,氯碱工业生产的一种流程如图:
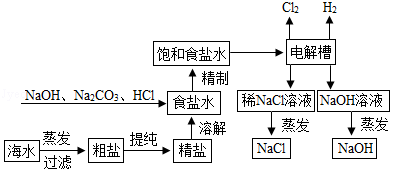
(1)从“海水→粗盐→精盐”的过程包括溶解、过滤、蒸发等实验操作,实验室中上述3种操作都需要使用的仪器是 (填名称)
22等物质,“精制”过程中加入NaOH的目的是 。
(3)写出“电解槽“中发生反应的化学方程式 ,流程中可以循环使用的物质有 (填化学式)
23和NaCl等杂质,用“离子交换膜法”生产的碱样品质量主要标准如下表所示
等级 |
氢氧化钠含量 |
碳酸钠含量 |
优等品 |
≥99.0% |
≤0.5% |
一等品 |
≥98.5% |
≤0.8% |
合格品 |
≥98.0% |
≤1.0% |
23的原因是 23,下列试剂中可选择使用的是
a.酚酞 b.稀盐酸c。澄清石灰水
②李老师设计和完成了如下实验来判断碱样品的等级。
3)固体0.197g;向滤液中加入几滴酚酞,再逐滴加入稀盐酸至恰好完全反应,共消耗溶质质量分数为5%的稀盐酸365g。该碱样品的等级是 (不考虑其他杂质参加反应)
铁的冶炼与利用是学习和研究化学的重要课题。
Ⅰ.铁的冶炼。竖炉炼铁的工艺流程如图1所示。
4燃烧的作用是
(2)写出“还原反应室”中炼铁的一个反应的化学方程式 。
422242的质量(m)范围是 。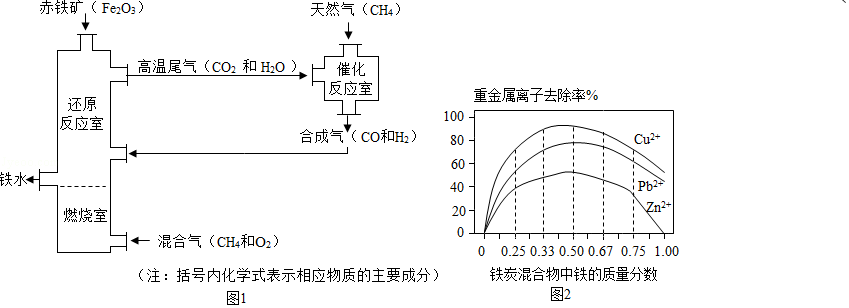
323232的铜冶炼废水。在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中重金属离子的去除率,实验结果如图2所示。
2+2+2+不能被除去,其原因是 。
(2)铁炭混合物中铁的质量分数为0时,也能除去水中少量的重金属离子,其原因是 。
(3)处理效果最好时,铁炭混合物中的铁的质量分数为 。
如图装置可用于多次连续进行氧气的制取和性质的实验。
(1)仪器Y的名称是 。
(2)水泥负载二氧化锰小球用于实验时的主要优点是 。该实验中收集氧气的方法是 。
(3)做氧气的性质实验时,实验不同,Z的作用不同。
①铁丝燃烧。Z为水,其作用是 。
②硫粉燃烧。Z为NaOH溶液,其作用是 。
③蜡烛燃烧。Z为 ,其作用是验证蜡烛中含有碳元素。
(4)实验时需要1.6g氧气,至少需要加入多少克5%的过氧化氢溶液。(写出计算过程)

某化学课外活动小组的同学为了测定某氮化镁样品中Mg3N2的质量分数,他们取氮化镁样品5.0g于烧杯中,加入100g某浓度的盐酸(足量),充分反应后(杂质不溶于水也不与盐酸反应),测得剩余固体的质量为1.0g。请计算:
(1)已知:Mg3N2与盐酸反应的生成物只有氯化镁和氯化铵,则在配平的该化学反应方程式中,HCl前面的化学计量数为 。
(2)氮化镁样品中Mg3N2的质量分数。(写出计算过程)
(3)此时所得溶液中氯化镁的质量分数。(写出计算过程)
小英同学用某铁合金样品做了如下实验:称量11.4g样品,放入质量为40g的烧杯中,再往烧杯中加入200g稀硫酸,恰好完全反应(杂质不与酸反应,也不溶于水)。反应完毕后称量,烧杯及烧杯内物质总质量为251g。求:
(1)反应产生的氢气质量为 g;
(2)所用稀硫酸的溶质质量分数(写出计算过程)。
我国早在西汉时期,就有“曾青得铁则化为铜”的记载,即把铁片放入硫酸铜溶液中可以置换出铜。11.2g铁与足量的硫酸铜溶液反应,理论上可得到铜的质量是多少?
某研究性学习小组欲测定石灰石中碳酸钙的质量分数,采用的方法如下:取该石灰石样品5g,把 60g稀盐酸分四次加入,实验过程所得数据如下表(已知石灰石样品中含有的杂质 不溶于水,也不与稀盐酸反应)。根据实验数据计算:
| 实验次数 |
1 |
2 |
3 |
4 |
| 加入稀盐酸的质量/g |
15 |
15 |
15 |
15 |
| 剩余固体的质量/g |
3.50 |
2.00 |
0.75 |
0.75 |
(1)石灰石样品中碳酸钙的质量分数为 。
(2)求原 60g 稀盐酸中溶质质量分数(要求书写计算过程)。
高铁酸钠(Na 2FeO 4)是一种高效多功能水处理剂,工业上常采用次氯酸钠(NaClO)氧化法生产,反应原理用化学方程式表示为:3NaClO+2Fe(NO 3) 3+10NaOH=2Na 2FeO 4↓+3NaCl+6NaNO 3+5H 2O
(1)次氯酸钠(NaClO) 中Cl元素的化合价为 ;
(2)高铁酸钠(Na 2FeO 4)中铁元素和氧元素的质量比为 (填最简比);
(3)现要制得830kg含杂质20%的高铁酸钠,至少需要次氯酸钠的质量是多少?(列式计算)
将8.0g三氧化二铁加入到100.0g的稀硫酸溶液中,恰好完全反应。化学反应方程式为Fe2O3+3H2SO4═Fe2(SO4)3+3H2O.试计算:
(1)硫酸的相对分子质量是 ;
(2)稀硫酸溶液的溶质质量分数(计算结果精确到0.1%)。
试题篮
()