氢氧化钴[Co(OH)2]受热易分解,能与酸性溶液反应,可作涂料和清漆的干燥剂,制备方法为:①Co+2HCl=CoCl2+H2↑,②CoCl2+2NaOH=Co(OH)2↓+2NaCl。下列判断正确的是
| A.钴的金属活动性比铜的弱 | B.①为置换反应,②为复分解反应 |
| C.氢氧化钴的化学性质稳定 | D.氢氧化钴可以干燥氯化氢气体 |
下列关于物质的组成、结构、性质及变化规律的总结,正确的是
| A.H2O、HCl、NaNO3均由不同种元素组成,属于混合物 |
| B.Fe、Fe2+、Fe3+三种微粒的质子数相同,化学性质也相同 |
| C.浓H2SO4、NaOH都具有吸水性,故它们都能用来干燥二氧化碳气体 |
| D.H2SO4、HCl都能使紫色石蕊试液变红色,是因为都含H+离子 |
下列有关酸的性质说法正确的是
| A.浓盐酸、浓硫酸都能使纸张炭化 |
| B.稀盐酸和稀硫酸都可用于除铁锈 |
| C.浓盐酸、浓硫酸都可用来干燥氧气 |
| D.打开盛有浓盐酸和浓硫酸的试剂瓶瓶塞,在瓶口都有白雾 |
A是一种黑色难溶于水的氧化物。请分析如下转化关系并填空。
(1)用化学式表示:A C
溶液B中的溶质是 溶液D中的溶质是
(2)用化学方程式表示:① A + 硫酸 ② 蓝色溶液B + 铁粉
物质的结构决定性质,下列有关说法错误的是()
| A. | 过氧化氢与水化学性质不同的原因是由于分子构成不同 |
| B. | 盐酸与硫酸化学性质相似的原因是在水溶液中都含有 |
| C. | 氢氧化钠与氢氧化钙化学性质相似的原因是在水溶液中都含有 |
| D. | 金刚石与石墨物理性质差异较大的原因是由于碳原子的结构不同 |
要使右图装置中的小气球鼓起来,则使用的固体和液体可以是()

①硝酸铵和水; ②铁和稀硫酸; ③固体氢氧化钠和水;
④生石灰和水; ⑤石灰石和稀盐酸
| A. | ①②③④⑤ | B. | ②③④⑤ |
| C. | ②③⑤ | D. | ②④⑤ |
金属镍及其化合物能发生下列反应:①Ni+2HCl=NiCl2+H2↑;②NiO+2HCl=NiCl2+H2O;③NiO2+4HCl=NiCl2+Cl2↑+2H2O;分析化学方程式可知,下列说法中错误的是
| A.镍能与硫酸铜溶液反应 |
| B.反应②属于复分解反应 |
| C.反应③中Ni的化合价由+4价变为+2价 |
| D.上述3个反应中涉及2种单质 |
(10分)在20mL溶质质量分数为1.60%的某硫酸铜溶液中,逐滴加入某浓度的氢氧化钡溶液(发生的反应类似于硫酸铜和氢氧化钠的反应),用电导仪测得溶液的电导率(电导率越高表示溶液的导电性越好)、溶液的pH值随滴入Ba(OH)2溶液体积的变化曲线如下图所示(假设所有稀溶液的密度均为l g/cm3)
(1)硫酸铜和氢氧化钡溶液发生反应的化学方程式为: :
(2)图I中C点所示溶液中,含量较多的微粒有: ,D点所示溶液能导电是因为溶液中含有 ;
(3)从图II中可知:将打磨过的铝片放入上述该硫酸铜溶液中,可以观察到的现象是: ;如有固体析出,请写出反应的化学方程式 。
向一定量的硫酸铜溶液中加入一定质量分数的氢氧化钡溶液,直至过量.生成沉淀的质量与加入氢氧化钡溶液的质量关系如图所示,下列说法中正确的是( )
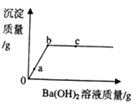
| A. | 0﹣ 段只生成氢氧化铜沉淀 |
| B. | 室温下, 点溶液的 >7 |
| C. | 点溶液中溶质至少有两种 |
| D. | 整个过程中,溶液中氢元素的质量一直在增加 |
请分析、比较以下几组化学反应,得出结论。
| 组别 |
化学方程式 |
结论 |
| I |
|
反应物相同,生成物不同, 原因。 |
| II |
|
反应物相同,生成物不同, 原因。 |
| III |
|
反应物相同,生成物不同, 原因。 |
| IV |
(反应缓慢) (反应迅速) |
反应物相同,反应速率不同, 原因。 |
| 实践与应用 |
科学探究正努力实现对化学反应的控制,很多化学家致力于研究二氧化碳的"组合转化"技术,把过多二氧化碳转化为有益于人类的物质。若让二氧化碳和氢气在一定条件下反应,可生成一种重要的化工原料,反应的化学方程式如下: ,推断X的化学式是。 |
某化学小组向一定量
和
混合溶液中加入一定量的
粉,充分反应后过滤得溶液
和固体
.
对滤液
所含的溶质有以下几种猜想:
①
、
、
② 、
③ 、
④只有
经过讨论大家一致认为不合理的猜想是(填标号),其理由是.
【实验探究】若猜想④成立,通过以下实验可确定固体
的成分,请将下表填写完整.
| 实验步骤 |
现 象 |
固体
的成分 |
| 有气泡产生 |
由于二氧化碳与氢氧化钠反应无明显现象,对此同学们展开了探究,请你参与.
【提出问题】二氧化碳与氢氧化钠能否发生反应?
【查阅资料】常温下,氢氧化钠、碳酸钠在乙醇中的溶解性如下.
| 溶剂 |
乙醇 |
|
| 溶质 |
氢氧化钠 |
碳酸钠 |
| 溶解性 |
易溶 |
难溶 |
【方案设计】小明同学设计了如图所示装置进行探究。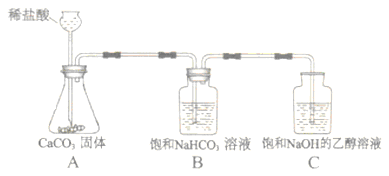
【实验探究】
(1)溶液配制.甲溶液:将一定质量的氢氧化钠固体加入到一定体积的乙醇中,用玻璃棒不断搅拌,使其成为饱和氢氧化钠的乙醇溶液.量取一定体积的乙醇要用到的仪器是,用玻璃棒搅拌的目的是。
乙溶液:将一定质量的氢氧化钠固体加入到一定体积的75%的乙醇溶液中,用玻璃棒不断搅拌,使其成为不饱和氢氧化钠的乙醇溶液.判断甲、乙溶液形成的现象是。
(2)进行实验,按图所示装置加入药品后进行实验.
中发生反应的化学方程式为,
装置的作用是,
中观察到的现象是。
【实验结论】
(3)由此小明得出二氧化碳与氢氧化钠发生了化学反应,反应的化学方程式为。
【反思交流】
(4)小刚同学认为小明的实验还足以证明二氧化碳与氢氧化钠发生了化学反应,还应补充的实验是。
(5)若将图
中甲溶液换成乙溶液进行实验,
中可能无明显现象发生,原因可能是。
工业用煤燃烧产生二氧化硫,在排放前需经处理,如图是两种除硫工艺中主要物质的转化路径(部分产物已略)。

若每1000
和
的市场价格分别按0.36元、2.90元计算,下列说法不正确的是()
| A. | 煤是不能再生的化石燃料 |
| B. | 反应Ⅰ的化学反应方程式为: |
| C. | "双碱法"中的 可以循环使用,节约成本 |
| D. | 处理相同的 ,"钠碱法"所需的原料成本更低 |
结合
、
的相关知识,回答下列问题
(1)可用来改变酸性土壤的固体是;
(2)从微观角度看,它们的溶液具有相似化学性质的原因是;
(3)除去
溶液中混有的少量
,可选用的试剂是。
固体混合物A是由
、
、
、
、
、
中的几种混合而成为,为确定其成分,进行如图实验.(假设每步反应均恰好完全反应)

试推断:
(1)气体B是。
(2)固体A中一定没有的物质是。
(3)滤液D中一定有含有的溶质是。
(4)固体A的组成可能有种。
试题篮
()