已知硫酸钾,氯化钾的水溶液都呈中性,根据下图所示的信息计算:
(1)加入的稀硫酸溶液的质量为 克。
(2)反应后所得溶液的溶质质量分数。
(3)拓展:若用等质量等质量分数的盐酸代替稀硫酸,充分反应后测定溶液的酸碱度,你认为pH 7(填>或=或<),理由是 。
鸡蛋壳的主要成分是碳酸钙。某兴趣小组为了测定鸡蛋壳中CaCO3的含量,现取15g鸡蛋壳与80g稀盐酸充分反应(蛋壳中的其他成分不溶于水,也不与稀盐酸反应),测得烧杯中的反应剩余物的质量(m)与反应时间(t)的关系如图所示。试计算:
(1)产生CO2的质量为 g;
(2)该鸡蛋壳中的CaCO3的质量分数。(写过程)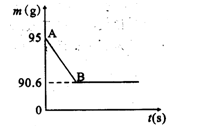
地沟油中含有一种强致癌物质黄曲霉素
(化学式:
),长期食用会引起消化道癌变。请计算:
(1)黄曲霉素
的相对分子质量。
(2)
黄曲霉素
中含氧元素的质量(精确到
)。
人体缺钙易产生“骨质疏松症”,补钙保健品“盖中盖”钙片中的有效成分为碳酸钙[CaCO3],试计算:
(1)碳酸钙的相对分子质量
(2)计算:碳酸钙中Ca、C、O三种元素的质量比
(3)碳酸钙中钙元素的质量分数
我国科学家在人工合成淀粉领域取得了突破性进展,其基本变化过程为“ 。”淀粉中C、H元素的质量之比为 _____,C的质量分数为_____ (计算结果保留一位小数,下同)。
为测定某实验废液中硫酸铜和硫酸的质量分数,分别在三只烧杯中倒入50g废液,并在烧杯中依次加入一定量的铁粉。实验结束后,测得的数据见如表:
|
第一组 |
第二组 |
第三组 |
|
|
反应前加入铁粉质量/g |
5.6 |
8.4 |
11.2 |
|
反应后剩余固体的质量/g |
3.2 |
3.2 |
6.0 |
|
反应后质量( )损失/g |
0.1 |
0.2 |
0.2 |
请回答:
(1)对比第一、二组数据,第一组实验结束后,废液中的 (填化学式)已全部参加反应;
(2)通过分析第二、三组数据,50g废液与铁粉反应生成氢气质量最多为 ;
(3)经计算,50g废液中所含硫酸的质量为 ,硫酸铜的质量分数为
硫氧粉( )可用作染漂脱氧剂,常因氧化变质生成 。向20g可能被氧化的样品中,加入质量分数为10%的稀硫酸至恰好不再产生气泡(假设气体全部逸出),消耗稀硫酸98g。已知: 。
(1)根据化学式判断 和 中钠元素的质量分数较小的是 。
(2)若用5g质量分数为98%的浓硫酸配制10%的稀硫酸,求所需水的质量。
(3)求反应后溶液中溶质的质量分数。(精确到小数点后一位)
医用碳酸氢钠片可用于治疗胃酸过多,某同学为测定其中碳酸氢钠的质量分数,取10.0g样品放入烧杯中,分两次加入稀盐酸(该实验条件下杂质不参与反应),充分反应。测定实验数据如表。
|
加盐酸的次数 |
第一次 |
第二次 |
|
加盐酸的质量g |
40.0 |
40.0 |
|
生成气体的质量/g |
3.3 |
1.1 |
(1)两次加稀盐酸后,生成二氧化碳的总质量是 g;
(2)该样品中碳酸氢钠的质量分数(写出计算过程)。(反应的化学方程式为: )
在牙膏中,常用轻质碳酸钙粉末等作摩擦剂。已知某品牌牙膏中的摩擦剂是 和 ( 既不溶于水也不与稀盐酸反应),化学兴趣小组用该牙膏的摩擦剂测定某盐酸中溶质的质量分数,通过实验测得如图数据:(假设产生气体全部逸出)

(1)生成 的质量为 g。
(2)求稀盐酸中溶质的质量分数。(写出计算过程)
碳酸氢钠俗称小苏打,在生产生活中应用广泛。
(1)如果少量的酸沾到皮肤或衣物上,常用3%~5%的 溶液处理。现用5g的 配制成溶质质量分数为4.0%的溶液,需加入水的质量是 g。
(2)某小苏打样品中混有少量 ,为了测定样品中 的质量分数,取10.0g样品加热到质量不再减小,共收集到二氧化碳2.2g, 受热分解的化学方程式为 。求该样品中 的质量分数。(写出计算过程)
为测试学生的实验和计算能力,老师准备了一瓶没有贴标签的过氧化氢溶液,同学们取部分溶液进行了如图实验,请结合实验回答下列问题:

(1)上述实验过程中发生反应的化学方程式为 。
(2)产生氧气的质量为 g。
(3)根据生成氧气的质量列出求解参加反应的过氧化氢质量(x)的比例式 。
(4)计算上述过氧化氢溶液中溶质的质量分数,并填写在答题卡的标签上(标签样式如图) 。

(5)若配制上述浓度的过氧化氢溶液300g,需要30%的过氧化氢溶液 g。
维生素可以起到调节新陈代谢、预防疾病、维持身体健康的重要作用。缺乏维生素A 1(C 20H 30O),会引起夜盲症。请回答:
(1)维生素A 1属于 (选填"无机物"或"有机物")
(2)维生素A 1相对分子质量为 ;
(3)维生素A 1中碳元素和氢元素的质量比 (写最简整数比)。
下图为某药厂生产的“新盖中盖牌”高钙片标签上的部分文字,请仔细阅读后回答下列问题。
| [主要原料]碳酸钙(CaCO3)、维生素D [功效成份]补钙 每片中含钙: (以Ca计)500 mg 维生素D 100 IU [食用方法] 每日1次,每次1片 [规 格] 2.5g/片 |
(1)计算碳酸钙中钙元素的质量分数
(2)计算高钙片中碳酸钙的质量分数?(写出计算过程)
(7分)实验室有一瓶未知浓度的氯化钡溶液,为测定其浓度做了如下实验:取该溶液20.OmL(密度约为l.Og/mL)放入锥形瓶中,逐滴加入一定量9.8%的硫酸溶液至恰好完全反应。过滤、洗涤、干燥,称量沉淀质量为2.33g。
请计算:(所有计算结果保留小数点后一位)
(1)20.0mL氯化钡溶液中氯化钡的质量是多少?其溶质质量分数是多少?
(2)欲配制100.Og9.8%的稀硫酸完成该实验,需要98.O%的浓硫酸多少克?
如图是已破损的维生素C(简写Vc,)其化学式:C6H8OX,的说明书部分信息。已知维生素C由碳、氢、氧三种元素组成。请回答:
(1)Vc中碳、氢元素的质量比为 ;
(2)Vc的化学式为 ;
(3)小辉妈妈每天服用该Vc片剂,小辉建议妈妈可食用西红柿来代替Vc片,若100g[西红柿含Vc30mg,则小辉妈妈每天食用西红柿 g即可达到服用上述Vc片的效果。
(4)最近根据市场调查发现不合格奶粉有所抬头。根据标准,合格奶粉每100克中含蛋白质约18克,蛋白质中氮元素的平均质量分数为16%,现测定某奶粉每100克中含有氮元素的质量为2.5克。则这种奶粉是否为“合格”奶粉?(列出计算过程)
试题篮
()