氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
(1)已知:H—H键能为436 kJ/mol,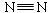 键能为945 kJ/mol,N—H键能为391 kJ/mol。写出工业合成氨反应的化学方程式 ;由键能计算说明此反应是 反应(填“吸热”或“放热”),合成氨反应(消耗1molN2 时)的△H = 。
键能为945 kJ/mol,N—H键能为391 kJ/mol。写出工业合成氨反应的化学方程式 ;由键能计算说明此反应是 反应(填“吸热”或“放热”),合成氨反应(消耗1molN2 时)的△H = 。
(2)恒温下,向一个2L的密闭容器中充入1 mol N2和2.6 mol H2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
| 时间/min |
5 |
10 |
15 |
20 |
25 |
30 |
| c(NH3)/(mol/L) |
0.08 |
0.14 |
0.18 |
0.20 |
0.20 |
0.20 |
5min内,用N2浓度的变化表示的反应速率为 ,此条件下该反应的化学平衡常数K= ;反应达到平衡后,保持温度、容积不变,若向平衡体系中加入0.4 mol N2 、 1 mol H2和0.2 mol NH3 ,化学平衡将
向 方向移动(填“正反应”或“逆反应”)。
(3)氨是氮肥工业的重要原料。某化肥厂生产铵态氮肥(NH4)2SO4的工艺流程如下: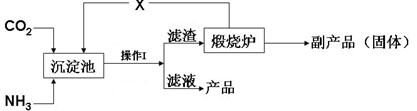
①向沉淀池中加入CaSO4悬浊液后,需先通入足量NH3,再通入CO2的原因是 。操作Ⅰ的名称是 。
②煅烧炉中产生的固态副产品为 ,生产流程中能被循环利用的物质X为 。








 粤公网安备 44130202000953号
粤公网安备 44130202000953号