有A、、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,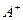 比
比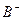 少一个电子层,B原子得一个电子后3p轨道全满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于中子数。R是由A、D两元素形成的离子化合物,其中A与D离子数之比为2:1。请回答下列问题:
少一个电子层,B原子得一个电子后3p轨道全满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于中子数。R是由A、D两元素形成的离子化合物,其中A与D离子数之比为2:1。请回答下列问题:
(1)A单质、B单质、化合物R的熔点大小顺序为下列的 (填序号)。
①单质>B单质>R ②R>A单质>B单质
③单质>R>A单质 ④A单质>R>B单质
(2)在CB3分子中C元素原子的原子轨道发生的是________杂化,其固体时的晶体类型为 。
(3)写出D原子的核外电子排布式 _,C的氢化物比D的氢化物在水中溶解度大得多的可能原因 。
(4)下图是D和Fe形成的晶体FeD2最小单元“晶胞”,FeD2晶体中阴、阳离子数之比为 ,FeD2物质中具有的化学键类型为 。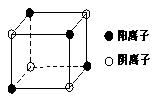








 粤公网安备 44130202000953号
粤公网安备 44130202000953号