已知:在25时H2O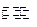 H++OH- KW=10-14
H++OH- KW=10-14
HAC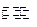 H++A
H++A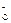 Ka=1.8×10-5
Ka=1.8×10-5
(1)醋酸钠水解的平衡常数Kh的表达式为 。当升高温度时,Kh将 (填“增大”“减小”“不变”);
(2)0.5mol·L-1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)为a;1mol·L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为 ,a与b的关系为 (填“大于”“小于”“等于”);
(3)在某溶液中含Mg2+、Cd2+、Zn2+三种离子的浓度均为 0.01mol·L-1。向其中加入固体醋酸钠,使其浓度为0.9mol·L-1,以上三种金属离子中 能生成沉淀,原因是 。(KSP[Mg(OH)2]=1.8×10-11、KSP[Zn(OH)2]=1.2×10-17、KSP[Cd(OH)2]=2.5×10-14、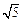 =2.2)
=2.2)








 粤公网安备 44130202000953号
粤公网安备 44130202000953号