Ⅰ铁盐、亚铁盐是实验室常用的药品。
请根据题意,完成下列填空:
(1)向酸化的FeCl3溶液中逐滴加入KI溶液,溶液变成棕褐色。该反应的离子方程式为 。
(2)向酸化的FeSO4溶液中加几滴硫氰化钾溶液,没有什么明显变化,再滴加双氧水,溶液变红色。继续滴加双氧水,红色逐渐褪去,且有气泡产生。
写出上述变化中,有关反应的离子方程式:
①
②Fe3++3SCN-=Fe(SCN)3
③11H2O2+2SCN-=2SO42-+2CO2↑+N2↑+10H2O+2H+
若生成1mol N2,H2O2和SCN-的反应中转移电子的物质的量是 mol。
(3)根据以上实验,推断Fe2+、I-和SCN-的还原性由强到弱的顺序为 。
Ⅱ某课题组利用Fe粉和KNO3溶液反应,模拟地下水脱氮过程,探究脱氮原理。
(4)实验前:①先用0.1 mol·L-1H2SO4洗涤Fe粉,其目的是 ,然后用蒸馏水洗涤至中性;②将KNO3溶液的pH调至2.5;③为防止空气中的O2对脱氮的影响,应向KNO3溶液通入 (写化学式)。
(5)如图表示足量Fe粉还原上述KNO3溶液过程中,测出的溶液中相关离子浓度、pH 随时间的变化关系(部分副反应产物曲线略去)。请根据图中信息写出t1时刻前该反应生成的阳离子分别是 、 。t1时刻后,该反应仍在进行,溶液中NH4+的浓度在增大,Fe2+的浓度却没有增大,可能的原因是 。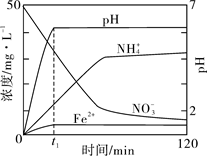








 粤公网安备 44130202000953号
粤公网安备 44130202000953号