将CO2转化为甲醇的原理为 CO2(g)+3H2(g) 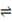 CH3OH(g)+H2O(g) ΔH <0 。500 ℃时,在体积为1 L的固定容积的密闭容器中充入1mol CO2、3mol H2,测得CO2浓度与CH3OH 浓度随时间的变化如图所示,从中得出的结论错误的是
CH3OH(g)+H2O(g) ΔH <0 。500 ℃时,在体积为1 L的固定容积的密闭容器中充入1mol CO2、3mol H2,测得CO2浓度与CH3OH 浓度随时间的变化如图所示,从中得出的结论错误的是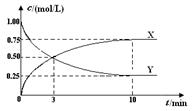
| A.曲线X可以表示CH3OH(g) 或H2O(g) 的浓度变化 |
| B.从反应开始到10min时,H2的反应速率v(H2)=0.225mol/(L﹒min) |
| C.平衡时H2的转化率为75% |
| D.500 ℃时该反应的平衡常数K=3 |
将CO2转化为甲醇的原理为 CO2(g)+3H2(g) 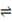 CH3OH(g)+H2O(g) ΔH <0 。500 ℃时,在体积为1 L的固定容积的密闭容器中充入1mol CO2、3mol H2,测得CO2浓度与CH3OH 浓度随时间的变化如图所示,从中得出的结论错误的是
CH3OH(g)+H2O(g) ΔH <0 。500 ℃时,在体积为1 L的固定容积的密闭容器中充入1mol CO2、3mol H2,测得CO2浓度与CH3OH 浓度随时间的变化如图所示,从中得出的结论错误的是
| A.曲线X可以表示CH3OH(g) 或H2O(g) 的浓度变化 |
| B.从反应开始到10min时,H2的反应速率v(H2)=0.225mol/(L﹒min) |
| C.平衡时H2的转化率为75% |
| D.500 ℃时该反应的平衡常数K=3 |
试题篮
()