)2013年全国各地连续出现了严重的雾霾天气,给人们的出行及身体造成了极大的危害,因此研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
I.脱硫技术能有效控制SO2对空气的污染。
(1)海水呈弱碱性,主要含有Na+、K+、Ca2+、Mg2+、CI-、SO42-、Br-、HCO3-等离子。含SO2的烟气可利用海水脱硫,其工艺流程如下图所示: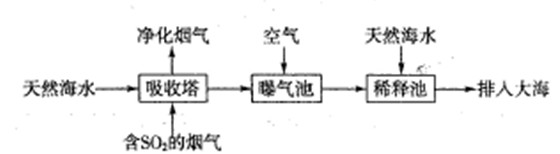
①向曝气池中通入空气的目的是
②通入空气后曝气池中海水与天然海水相比,浓度没有明显变化的离子是 。
a.Cl- B.SO42- C.HCO3-
(2)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示。(电极材料为石墨)
①图中b极要连接电的(填“正”或“负”) 极,C口流出的物质是 。
②SO32-放电的电极反应式为
③电解过程中阴极区碱性明显增强,用平衡移动原理解释原因 。
II.我国的能消费结构以燃煤为主,将煤气化可减少环境污染,但煤气化过程中能产生有害气体H2S,用足量的Na2CO3溶液可吸收,该反应的离子方程式为 。
(已知:H2S Kal=9.1×10-8;Ka2=1.1 ×10-12;H2CO3 Kal=4.30×10-7;Ka2=5.61 ×10-11)








 粤公网安备 44130202000953号
粤公网安备 44130202000953号