第4周期元素由于受3d能级电子的影响,性质的递变规律与短周期元素略有不同。
Ⅰ.第4周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的。镓(31Ga)的基态原子的电子排布式是 ;31Ga的第一电离能却明显低于30Zn的,原因是
。
Ⅱ.第4周期过渡元素的明显特征是形成多种多样的配合物。
(1)CO和NH3可以和很多过渡金属形成配合物。CO与N2互为等电子体,CO分子中C原子上有一对孤电子对,C、O原子都符合8电子稳定结构,则CO的结构式可表示为 。NH3分子中N原子的杂化方式为 杂化,NH3分子的空间立体构型是 。
(2)如图甲所示为二维平面晶体示意图,所表示的化学式为AX3的是 。 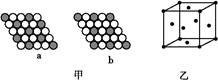
(3)图乙为一个铜晶胞,此晶胞立方体的边长为a cm,Cu的相对原子质量为64,金属铜的密度为ρ g/cm3,则阿伏加德罗常数可表示为 mol-1(用含a、ρ的代数式表示)。








 粤公网安备 44130202000953号
粤公网安备 44130202000953号