曾经有一种固氮的方法:1100°C通N2和CaC2反应得到CaCN2 。
已知:CaCN2+3H2O = 2NH3+CaCO3;CaC2+2H2O = C2H2↑+Ca(OH)2
(1)某同学采用以下装置(加热和夹持仪器已略去)制取少量的CaCN2
①U形管中盛放的物质是 (填一种);
② (填“能”或“不能”)用普通玻璃管代替图中石英管;
(2)检验反应后的固体(用W表示)中含有氮元素该同学将适量W溶于水,有气泡产生,说明固体中含有氮元素,该结论不正确。若要得出正确结论,还需进行的实验是 。
(3)测定W中CaCN2的质量分数
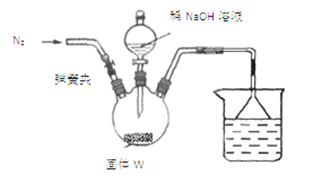
步骤Ⅰ:按如图所示装置(夹持仪器已略去)进行实验:关闭弹簧夹,将漏斗中溶液逐滴加入到三颈瓶中,当W反应完全后,打开弹簧夹,通入氮气,直至氨气被200mL0.1 mol·L-1硫酸完全吸收。
步骤Ⅱ:准确量取烧杯中溶液20.00mL置于锥形瓶中,滴入几滴指示剂,用cmol·L-1NaOH溶液滴定过量的硫酸,实验测得消耗标准溶液的平均体积为vmL。
已知三种常用指示剂变色pH范围如下:
| 指示剂 |
a |
b |
c |
| 变色pH范围 |
3.1~4.4 |
8.0~10.0 |
4.4~6.2 |
| 说明 |
pH<3.1显红色 pH>4.4显黄色 |
pH<8.0显无色 pH>10.0显红色 |
pH<4.4显红色 pH>6.2显黄色 |
①上述滴定过程中,不宜选用的指示剂是 (填字母序号);
②烧杯中最终吸收氨气的物质的量为 mol;经进一步计算可求得W中CaCN2质量分数。
③上述实验所得结果明显偏小,若不考虑装置的气密性和操作误差,则导致结果偏小的可能原因是
(写1种)。








 粤公网安备 44130202000953号
粤公网安备 44130202000953号