化学课上,同学们做了如下两个实验。
| 实验装置 |
实验现象 |
实验结论 |
 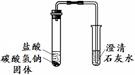 实验Ⅰ 实验Ⅱ |
实验I、II中均观察到:白色固体逐渐减少, ;澄清石灰水变浑浊。 |
Na2CO3和NaHCO3都能与盐酸反应产生CO2;NaHCO3与盐酸反应的化学方程式是 。 |
在实验过程中用手触摸试管,发现盛Na2CO3的试管变热,盛NaHCO3的试管变冷。
【提出问题】两个实验过程中,温度变化的原因是什么?
【猜想与假设】甲同学认为:Na2CO3和盐酸反应为放热反应,而NaHCO3和盐酸反应为吸热反应。
乙同学认为甲的猜想有不足之处。
【设计实验】乙同学欲通过实验进行研究,实验步骤如下:
①分别向盛有0.5 g Na2CO3固体、0.5 g NaHCO3固体的烧杯中加入10 mL水(20℃),搅拌,测量温度t1
②静置,测量温度t2
③分别加入10 mL 密度约为1.1 g/mL 20%的盐酸(20℃),搅拌,测量温度t3
【实验记录】多次实验后取平均值记录如下:
| |
t1/℃ |
t2/℃ |
t3/℃ |
| Na2CO3 |
23.3 |
20.0 |
23.7 |
| NaHCO3 |
18.5 |
20.0 |
20.8 |
【分析与结论】
(1)甲同学猜想的不足之处是 。通过步骤①得到的结论是 。
(2)通过步骤②和③得到的结论是:Na2CO3和NaHCO3与盐酸反应都是放热反应。
【反思与评价】
老师指出乙的设计仍存在不足,并补充做如下实验:向盛有10 mL水(20℃)的烧杯中加入10 mL密度约为1.1 g/mL 20%的盐酸(20℃),搅拌,测量温度为22.2℃。
(1)此实验的目的是 。
(2)结合此次探究活动,你认为下列说法不正确的是 (填序号)。
A.盐酸的稀释过程是放热过程
B.NaHCO3与盐酸的反应是放热反应
C.实验Ⅰ和Ⅱ中的能量变化与化学反应、物质的溶解和稀释有关








 粤公网安备 44130202000953号
粤公网安备 44130202000953号