I.某一反应体系中有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。
已知该反应中H2O2只发生如下过程:H2O2→O2。
(1) 该反应中的还原剂是________。
(2) 该反应中,发生还原反应的过程是________→________。
(3) 写出该反应的化学方程式,并标出电子转移的方向和数目:
_____________________ __ 。
(4)如反应转移了0.3mol电子,则产生的气体在标准状况下体积为________。
II.高锰酸钾在不同的条件下发生的反应如下:
MnO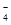 +5e-+8H+===Mn2++4H2O ①
+5e-+8H+===Mn2++4H2O ①
MnO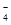 +3e-+2H2O===MnO2↓+4OH- ②
+3e-+2H2O===MnO2↓+4OH- ②
MnO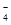 +e-===MnO
+e-===MnO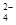 (溶液绿色) ③
(溶液绿色) ③
(1) 从上述三个半反应中可以看出高锰酸根离子被还原的产物受溶液的________影响。
(2) 将SO2通入高锰酸钾溶液中,发生还原反应的离子反应过程为
__________→___________。
(3) 将PbO2投入到酸性MnSO4溶液中搅拌,溶液变为紫红色。下列说法正确的是________
a. 氧化性:PbO2>KMnO4
b. 还原性:PbO2>KMnO4
c. 该反应可以用盐酸酸化
(4) 将高锰酸钾逐滴加入到硫化钾溶液中发生如下反应,其中K2SO4和S的物质的量之比为3∶2, 完成下列化学方程式(横线上填系数,括号内填物质):
① ________KMnO4+________K2S+______( )===________K2MnO4+________K2SO4+________S↓+______( )。
② 若生成6.4g单质硫,反应过程中转移电子的物质的量为________。








 粤公网安备 44130202000953号
粤公网安备 44130202000953号