(物质结构与性质)金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”。
(1)Ti基态原子的电子排布式为: 。
(2)钛能与B、C、N、O等非金属元素形成稳定的化合物。电负性:C (填“>”或“<”,下同)B;第一电离能:N O 。
(3)月球岩石——玄武岩的主要成分为钛硫酸亚铁 与80%的硫酸反应可生成
与80%的硫酸反应可生成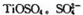 的空间构型为 形,其中硫原子采用 杂化。
的空间构型为 形,其中硫原子采用 杂化。
(4)磷酸肽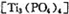 锂离子电池能来那个密度大、安全性高。
锂离子电池能来那个密度大、安全性高。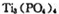 可由
可由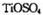 与
与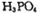 反应制得。两分子
反应制得。两分子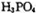 发生脱水生成焦磷酸:
发生脱水生成焦磷酸: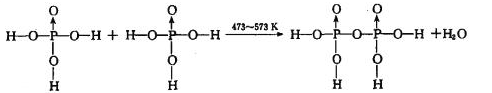
则三分子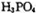 脱去两分子
脱去两分子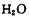 生成三磷酸,其结构式为 ,四分子
生成三磷酸,其结构式为 ,四分子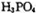 脱去四分子
脱去四分子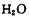 生成的四偏磷酸属于 元酸。
生成的四偏磷酸属于 元酸。
(5)Ti的氧化物和CaO相互作用能形成太酸盐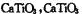 的晶体结构如图所示(Ti位于立方体的顶点)。该晶体中Ti4+和周围 个O2-紧邻。
的晶体结构如图所示(Ti位于立方体的顶点)。该晶体中Ti4+和周围 个O2-紧邻。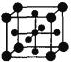
(6)Fe能形成多种氧化物,其中FeO晶胞结构为NaCl型。晶体中
实际上存在空位、错位、杂质原子等缺陷,晶体缺陷对晶体的性质会产生重
大影响。由于晶体缺陷,在晶体中Fe和O的个数比发生了变化,变为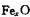 (x<1),若测得某
(x<1),若测得某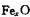 晶体密度为5.71g·cm-3,晶胞边长为4.28×
晶体密度为5.71g·cm-3,晶胞边长为4.28× m,则
m,则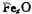 中x= 。
中x= 。








 粤公网安备 44130202000953号
粤公网安备 44130202000953号