碘溶于碘化钾溶液中形成I3-,并建立如下平衡:I3-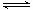 I-+ I2。实验室可以通过氧化还原滴定法测定平衡时I3-的浓度。
I-+ I2。实验室可以通过氧化还原滴定法测定平衡时I3-的浓度。
实验原理:
为了测定平衡时的c(I3-),可用过量的碘与碘化钾溶液一起摇动,达平衡后取上层清液用标准的Na2S2O3滴定:2 Na2S2O3 + I2 =" 2NaI" + Na2S4O6。由于溶液中存在I3-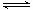 I-— + I2的平衡,所以用硫代硫酸钠溶液滴定,最终测得的是I2和I3-—的总浓度,设为c1,c1 = c(I2)+c(I3-);c(I2) 的浓度可用相同温度下,测过量碘与水平衡时溶液中碘的浓度代替,设为c2,则c(I2)= c2,c(I3-)=c1 —c2;
I-— + I2的平衡,所以用硫代硫酸钠溶液滴定,最终测得的是I2和I3-—的总浓度,设为c1,c1 = c(I2)+c(I3-);c(I2) 的浓度可用相同温度下,测过量碘与水平衡时溶液中碘的浓度代替,设为c2,则c(I2)= c2,c(I3-)=c1 —c2;
实验内容:
(1)用一只干燥的100 mL 碘量瓶(测量过程中所用的一种密闭玻璃容器)和一只250 mL碘量瓶,分别标上1、2号,用量筒取80 mL 0.0100 mol.L-1 KI于1号瓶,取200 mL 蒸馏水于2号瓶,并分别加入0.5 g过量的碘。
(2)将两只碘量瓶塞好塞子,振荡30分钟,静置。
(3)分别取上层清液20 mL用浓度为c mol/L标准Na2S2O3溶液进行滴定。1号瓶消耗V1 mL Na2S2O3溶液,2号瓶消耗V2 mL Na2S2O3溶液。
(4)带入数据计算c(I3—)
试回答下列问题
①标准Na2S2O3溶液应装入 (填“酸式滴定管”或“碱式滴定管”),原因是 。
②碘量瓶在震荡静置时要塞紧塞子,可能的原因是 。
③滴定时向待测液中加入的指示剂是 ,到达滴定终点时的现象为 。
④用c 、V1和V2表示c(I3-)为 mol·L-1。
⑤若在测定1号瓶时,取上层清液时不小心吸入了少量的I2固体,则测定的c(I3-)
(填“偏大”、“偏小”或“不变”)








 粤公网安备 44130202000953号
粤公网安备 44130202000953号