A、B、C、D、E都是周期表中前四周期的元素。已知A原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大。B的基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数相同,B位于元素周期表的S区。C元素原子的外围电子层排布式为nsn—1npn—1。D原子M能层为全充满状态,且最外层无成对电子,E的化合物种类最多。请回答下列问题:
(1)写出D基态原子的电子排布式 ;
(2)A的常见氢化物AH3 的VSEPR模型为
(3)已知A和C形成的化合物X中每个原子的最外层均为8电子稳定结构,则X的化学式为 ,X是一种超硬物质,耐磨损、抗腐蚀能力强,
推测X的晶体类型为 。
(4)E的最高价氧化物的结构式为 中心原子的杂化方式为 。
(5)B的单质与A的最高价含氧酸的稀溶液反应,能将A还原至最低价态,写出该反应的化学方程式 。
(6)TiO2的天然晶体中,最稳定的一种晶体结构如下图,黑球表示 原子。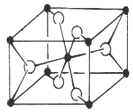
(7)二茂铁(C5H5)2Fe是Fe2+与环戊二烯基离子结合形成的小分子化合物,该化合物中Fe2+与环戊二烯基离子之间以 (填“离子键”、“金属键”、“配位键”、“氢键”、“范德华力”)相结合。








 粤公网安备 44130202000953号
粤公网安备 44130202000953号