(8分)钛(Ti)被誉为“21世纪的金属”。工业上将TiO2与焦炭混合,通入Cl2高温下制得TiCl4;再将TiCl4提纯后,在氩气保护下与镁高温反应制得Ti。其反应如下:
①TiO2+2Cl2+2C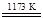 TiCl4+2CO
TiCl4+2CO
②TiCl4+2Mg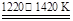 Ti+2MgCl2
Ti+2MgCl2
回答下列问题:
(1)Ti元素原子的电子排布式为_____________________;
(2)写出与CO互为等电子体的分子__________________;
(3)已知TiCl4在通常情况下是无色液体,熔点为–37℃,沸点为136℃;TiCl4在潮湿空气中易水解产生白雾,同时产生H2TiO3固体。
①TiCl4为______化合物(填“离子”或“共价”)(已知电负性:Ti—1.5,Cl—3.0);
②TiCl4分子为正四面体形,则Ti为________杂化;
③配离子[TiCl(H2O)5]2+的中心离子化合价为 ,中心离子配位数为 ;
(4)TiCl4在潮湿空气中水解的化学方程式为_____________________________________。








 粤公网安备 44130202000953号
粤公网安备 44130202000953号