X、Y、Z、W是原子序数依次增大的前四周期元素,X元素原子核外有三个能级,各能级电子数相等,Y的单质在空气中燃烧生成一种淡黄色的固体;Z元素原子的最外层电子数比次个层电子少数2,W的内层电子已充满,最外层只有一个电子。请回答:
(1)X元素在周期表中的位置是 ;W2+离子的核外电子排布式
(2)Y离子和Z离子比较,半径较大的是 (写离子符号),Z元素和氧元素的简单气态氢化物沸点不同的原因是
(3)Z元素的非金属性比 强,可由一复分解反应推测而得,其反应的化学方程式为
(4)X单质易溶于X与Z形成的三原子化合物中,该化合物分子中的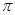 键与
键与 键的个数之比是 ;Y元素最高价氧化物对应水化物与小苏打反应的离子方程式为
键的个数之比是 ;Y元素最高价氧化物对应水化物与小苏打反应的离子方程式为
(5)用H2O2和Z元素最高价氧化物对应水化物的混合溶液可溶解W单质粉末,已知:
①W(s)+2H+(aq)=W2+(aq)+H2(g) ∆H=-64.39KJ/mol
②2H2O2(l)=2H2O(l)+O2(g)∆H=-196.46KJ/mol
③H2(g)+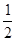 O2(g)= H2O(l) ∆H=" -285.84" KJ/mol
O2(g)= H2O(l) ∆H=" -285.84" KJ/mol
则在Z元素最高价氧化物对应水化物的溶液中,W与H2O2反应生成W2+与H2O的热反应化学方程式为








 粤公网安备 44130202000953号
粤公网安备 44130202000953号